Пороки сердца врождённые |
||
 |
 |
Оглавление
|
Пороки сердца врождённыеПороки сердца врождённые — групповое понятие, объединяющее аномалии положения и морфологической структуры сердца и крупных сосудов, возникающие в результате нарушения или незавершённости их формообразования в периоды внутриутробного и (реже) постнатального развития. Оглавление Отдельные группы врождённых пороков сердца Врождённые пороки сердца у взрослых Принципы лечения больных в предоперационном и послеоперационном периодах Общие сведенияМногие Пороки сердца врождённые формируют патологические условия общей и внутрисердечной гемодинамики, нарушающие жизнедеятельность, а иногда и несовместимые с жизнью больного (смотри полный свод знаний: Гемодинамика). История. Изучение Пороки сердца врождённые началось с 17 век, когда появились первые анатомические описания отдельных форм Пороки сердца врождённые, в частности описание Стеноном (N. Stenon или Stensen, 1671; 1673) эктопии сердца и сложного порока, известного сейчас как тетрада Фалло, а также описание Рейджером (С. Rayger, 1672) врождённого стеноза устья аорты. В 18 в. были впервые описаны врождённый стеноз лёгочного ствола и коарктация аорты, что связано с именами Де Сенака (J. В. De Senac), Меккеля (J. F. Meckel), Дж. Морганьи. К концу 19 век стало уже известным большинство основных форм Пороки сердца врождённые, была издана обобщающая работа К. Рокитанского «Дефекты сердечных перегородок» (1875) и началось основательное изучение вопросов патофизиологии, клиники и прижизненной диагностики Пороки сердца врождённые Представления о генезе Пороки сердца врождённые оформились в научную концепцию в первой трети 20 век, когда была сформулирована онтогенетическая теория их происхождения. Последующие достижения эмбриологии и современные генетические исследования существенно дополнили эти представления, но и в настоящее время многие вопросы генеза Пороки сердца врождённые остаются неизученными. По мере создания современных методов исследования функций системы кровообращения (смотри полный свод знаний), деятельности сердца (смотри полный свод знаний: Сердце, методы исследования), в частности с помощью катетеризации сердца (смотри полный свод знаний) и ангиокардиографии (смотри полный свод знаний), значительно прогрессировало изучение клинических аспектов проблемы Пороки сердца врождённые, чему особенно способствовала разработка методов хирургического их лечения, возглавлявшаяся в СССР Н. М. Амосовым, А. Н. Бакулевым, В. И. Бураковским, А. А. Вишневским, Б. А. Королевым, П. А. Куприяновым, Н. Н. Малиновским, Е.Н. Мешалкиным, Б. В. Петровским и другие. Статистика. Сведения о частоте Пороки сердца врождённые разноречивы. Согласно клиническим данным Пороки сердца врождённые встречаются не более чем у 1% обследуемых новорождённых; у детей старшего возраста и у взрослых частота их обнаружения намного меньше. По результатам вскрытий колебания в частоте Пороки сердца врождённые составляют от 0,45%, по данным Хаккензелльнера (Н. A. Hackensellner, 1959), до 4,15%, по данным Герттлера (К. Goerttler, 1963), то есть отмечается почти десятикратное различие показателей. Банкль (Н. Bankl, 1977), располагавший материалом 50 623 аутопсий, проведённых по единой методике у умерших разных возрастов (но с высокой долей вскрытий детей — 18%), определил частоту Пороки сердца врождённые в 1,9% от всех случаев аутопсий. Последний показатель, по-видимому, точнее отражает реальную распространённость Пороки сердца врождённые, если учитывать все формы аномалий независимо от их клинического значения. В то же время, неравномерность распределения известных и весьма вероятных причинных факторов возникновения пороков развития заставляет заранее предполагать возможные различия в частоте Пороки сердца врождённые по разным регионам мира. |
Наблюдается тенденция к возрастанию частоты пороков развития, особенно в развитых странах, со второй половины 20 в. Чаще других Пороки сердца врождённые встречаются открытый артериальный проток (смотри полный свод знаний), Фалло тетрада (смотри полный свод знаний) и дефекты межпредсердной и межжелудочковой перегородок. Смертность от Пороки сердца врождённые наиболее велика в раннем детском возрасте. Если не проводится оперативное лечение, то, по усреднённым данным, около 40% детей, родившихся с Пороки сердца врождённые, умирает в возрасте до 3 лет; по данным Банкла, из 1000 умерших с Пороки сердца врождённые 67% погибли в течение первого года жизни. При некоторых Пороки сердца врождённые, связанных с задержкой развития и обнаруживаемых у новорождённых, в части случаев отмечается спонтанное самоизлечение (завершение формообразования) в постнатальном периоде. Частота самоизлечения и смертность с возрастом уменьшаются.
Этиология даже одинаковых по морфологическому типу Пороки сердца врождённые, по-видимому, так же разнородна, как и этиология пороков развития вообще. В одних случаях решающее значение имеет наследственность, а также хромосомные аномалии в связи с гормональным дисбалансом и другими эндогенными причинами. В других случаях основную роль играют экзогенные факторы, приводящие к задержке или остановке развития морфологических структур сердца и сосудов в любой фазе органогенеза или же тератогенные воздействия в критические его периоды (ионизирующее излучение, интоксикации, вирусные инфекции, применение некоторых лекарств в период беременности и так далее). Генетическая природа части Пороки сердца врождённые находит отражение в известных хромосомных аномалиях, приводящих к развитию типичных сочетаний: синдрома Дауна и атриовентрикулярного канала, синдрома Марфана и аортального порока и другие Этиологическая роль наследственности, повидимому, ограничена. Е. Г. Костылев (1976) при изучении 2000 семей больных, оперированных по поводу Пороки сердца врождённые, смог установить роль наследственных факторов только в 29 семьях. Это обстоятельство подчёркивает важность изучения этиологической роли экзогенных воздействий, особенно в свете уже установленного тератогенного влияния ряда лекарств, применяемых в первом триместре беременности и перенесённых в этот период инфекционных заболеваний, например, краснухи.
Классификация. Многообразие форм Пороки сердца врождённые с разнородными сочетаниями аномалий сердца и сосудов затрудняет создание их классификации, унифицированной по группе однородных признаков, включающей все известные формы Пороки сердца врождённые и равно удовлетворяющей специалистов теоретической и практической медицины. Этим объясняется большое число классификаций Пороки сердца врождённые По состоянию функции кровообращения все Пороки сердца врождённые можно разделить на нарушающие эту функцию и на практически не изменяющие её. К последней группе относятся некоторые изолированные формы аномалии положения (декстрокардия, синистрокардия) и эктопии сердца, изолированное расширение лёгочного ствола (смотри полный свод знаний), неосложнённые врождённые дефекты перикарда (смотри полный свод знаний) и некоторые дивертикулы сердца. Большинство классификаций Пороки сердца врождённые создавалось с учётом клинических потребностей, то есть относилось прежде всего к порокам, нарушающим гемодинамику. Первые клинические классификации основывались на разделении Пороки сердца врождённые в зависимости от наличия и степени стойкости цианоза (смотри полный свод знаний). Так, одна из ранних клинических классификаций, предложенная Эбботтом и Досоном (М. Е. Abbott, W. Т. Dawson, 1924), состояла в разделении Пороки сердца врождённые на три группы: со стойким цианозом, с факультативным цианозом и без цианоза, причём в первой группе Пороки сердца врождённые дополнительно подразделялись на три подгруппы по степени выраженности цианоза. В какой-то мере классификация Пороки сердца врождённые на «синие» и «бледные» пороки ориентирует диагностику на определённые морфологические типы Пороки сердца врождённые, а степень цианоза во многих случаях соответствует серьёзности врождённой аномалии. В более поздних классификациях, в частности предложенных Тауссиг (Н. В. Taussig, 1947) и Донзело (Е. Donzelot) с соавторами (1954), учитывались патофизиологические механизмы гемодинамических нарушений: Тауссиг подчеркнула патогенетическую и прогностическую роль изменений при Пороки сердца врождённые лёгочного кровотока, а Донзело обособил группу пороков, характеризующихся прямым венозно-артериальным сообщением, выявление которого инструментальными методами более информативно для диагностики порока, чем цианоз. Значение изменений гемодинамики в малом круге кровообращения как для клинической характеристики типа порока, так п для его диагностики и установления показаний к оперативному лечению нашло отражение почти во всех последующих классификациях Пороки сердца врождённые, в частности в классификации, модифицированной П. А. Куприяновым, в которой Пороки сердца врождённые разделялись на три группы: с нормоволемией, гиперволемией и гиповолемией малого круга (дополнительно выделялись подгруппы «с цианозом» и «без цианоза»). Этот принцип в той или иной мере сохранен в большинстве современных классификаций, в том числе в классификациях Н. М. Амосова, В. И. Бураковского, Б. А. Королева, Е. Н. Мешалкина, В. С. Савельева, В. И. Францева и другие Для целей хирургической практики в этих классификациях используются как морфологические, так и функциональные признаки Пороки сердца врождённые, а в некоторых из них классифицируются также степени гемодинамических нарушений. Классификации отдельных форм Пороки сердца врождённые также подчинены обычно практическим целям и строятся с учётом ведущих гемодинамических признаков порока, выявляемых определёнными диагностическими методиками. Так, например, дефект межжелудочковой перегородки характеризуется разными исследователями по таким критериям гемодинамических нарушений, как направление сброса крови (лево-правый, перекрёстный, право-левый), величина сброса, степень гиперволемии или степень гипертензии малого круга кровообращения, величина лёгочного сопротивления и так далее
Не считая некоторых различий в отдельных классификациях, клинически значимые формы Пороки сердца врождённые подразделяют в соответствии с гемодинамическими нарушениями в основном на следующие группы.
Пороки с неизменённым или малоизменённым лёгочным кровотоком. Аномалии дуги аорты и её ветвей, отсутствие дуги аорты, стеноз аорты, коарктация аорты взрослого типа, атрезия аортального клапана, митральный стеноз, митральная атрезия, недостаточность митрального клапана, недостаточность клапана лёгочного ствола, трёх-предсердное сердце, пороки венечных артерий сердца, пороки проводящей системы сердца.
Пороки с гиперволемией малого круга кровообращения. 1. Не сопровождающиеся ранним цианозом: открытый артериальный проток, дефект межпредсердной перегородки, синдром Лютамбаше, дефект межжелудочковой перегородки, комплекс Эйзенменгера, аорто-лёгочный свищ, коарктация аорты детского типа. 2. Сопровождающиеся цианозом: трикуспидальная атрезия с нормальным калибром лёгочного ствола и большим дефектом межжелудочковой перегородки, а также открытый артериальный проток с током крови из лёгочного ствола в аорту и комплекс Эйзенменгера при выраженной гипертензии в сосудах малого круга.
Пороки с гиповолемией малого круга кровообращения. 1. Не сопровождающиеся цианозом: изолированный стеноз лёгочного ствола (инфундибулярный и клапанный). 2. Сопровождающиеся цианозом: триада Фалло, тетрада Фалло, пентада Фалло, трикуспидальная атрезия с сужением лёгочного ствола или малым дефектом межжелудочковой перегородки, аномалия Эбштейна, гипоплазия правого желудочка.
Комбинированные пороки: полная транспозиция аорты и лёгочного ствола, корригированная транспозиция аорты и лёгочного ствола, синдром Тауссиг — Бинга, отхождение аорты и лёгочного ствола от правого желудочка, отхождение аорты и лёгочного ствола от левого желудочка, общий артериальный ствол, трёх-камерное сердце с единым желудочком. К этой группе относятся Пороки сердца врождённые, при которых выявляются нарушения взаимоотношений между различными отделами сердца и крупными сосудами. При этом возможны разные варианты соотношений кровотока в малом и большом круге кровообращения или нарушения кровотока.
Отдельные группы врождённых пороков сердца
Поскольку клинические классификации Пороки сердца врождённые в известной мере условны и, как правило, не охватывают все встречающиеся аномалии, описание отдельных пороков дано в алфавитном порядке.
Аномалии вен большого круга кровообращения. Нарушения нормального развития венозной системы большого круга кровообращения могут привести к сохранению (вместо облитерации) левого кювьерова протока (общая кардинальная вена). В этом случае у больного сохраняется левосторонняя вертикальная вена (или левая верхняя полая вена), которая впадает в коронарный синус и собирает венозную кровь из левой верхней половины тела. Если при этом сохраняется левая плечеголовная вена, то вертикальная вена сообщается с правой верхней полой веной. Очень редко происходит аномальная облитерация правого кювьерова протока, и тогда венозная кровь верхней половины тела возвращается в сердце через левую вертикальную вену. При отсутствии нижней полой вены печёночные вены самостоятельно впадают в правое предсердие. Венозная кровь нижней половины тела протекает через расширенную непарную вену, впадающую в верхнюю полую вену. Очень редко полые вены впадают в левое предсердие. При этом обязательно сохраняется открытое овальное окно, возможен дефект межжелудочковой перегородки или открытый артериальный проток.
Аномалии венозного притока к сердцу сами по себе не сопровождаются нарушениями гемодинамики, за исключением тех вариантов, когда вены впадают в левое предсердие;
в этих случаях больные цианотичны, правый желудочек гипоплазирован. Коррекцию аномалии производят путём перемещения устья полых вен в правое предсердие или пластикой межпредсердной перегородки с использованием трансплантата из аутоперикарда.
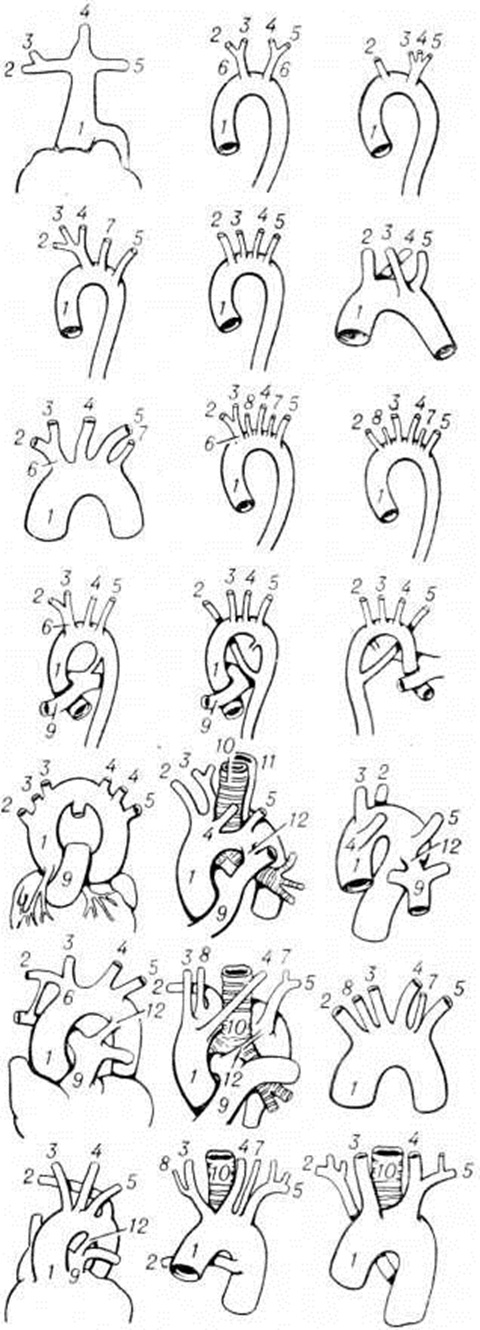
Аномалии дуги аорты и её ветвей. Порок связан с нарушением эмбриогенеза (вместо регрессии некоторые отделы артерий жаберных дуг сохраняются). В норме левая лёгочная артерия формируется из проксимальной части шестой дуги. Из её дистальной части слева образуется артериальный проток (смотри полный свод знаний). Дистальная часть его справа обычно регрессирует, исчезая полностью или сохраняясь в виде рудимента и очень редко как правосторонний открытый артериальный проток. Четвертая левая дуга превращается в восходящую часть нормальной аорты и соединяется с устьем левой общей сонной артерии (сегментом третьей дуги). Нарушения механизма обратного развития восьмого сегмента дорсальной аорты слева или справа в сочетании с аномалией четвертой артериальной дуги (также справа и слева) приводит к формированию двойной дуги аорты с различным соотношением её частей, к сохранению билатерального артериального протока и необычному отхождению магистральных артерий (подключичных и сонных). Разнообразие сочетаний аномалий дуги аорты и магистральных сосудов велико (более 20 сочетаний). Однако в практическом отношении имеют значение лишь некоторые из них (смотри рисунок 4): двойная дуга аорты (с узкой передней левой и широкой задней правой дугой, с широкой передней левой и узкой задней правой дугой), правая дуга аорты с левым артериальным протоком, аномальное отхождение левой общей сонной артерии (со смещением её устья вправо), аномальное расположение плечеголовного ствола или его ветвей (со смещением устьев вправо), левая дуга аорты с расположенным справа артериальным протоком, крайне левое отхождение правой подключичной артерии, правая аортальная дуга с расположением нисходящей грудной аорты слева, левая аортальная дуга с лежащей справа нисходящей грудной аортой.
Клиническая картина независимо от вида аномалий связана со сдавлением трахеи или (и) пищевода. Степень сдавления определяет тяжесть течения болезни (от лёгкой до выраженной). Затруднения проглатывания и особенно дыхания у детей являются наиболее частыми признаками порока. Стридорозные явления (смотри полный свод знаний: Стридор) могут резко усиливаться и вызывать приступы тяжёлой одышки. Возможна аспирация рвотных масс. Разгибание головы иногда даёт облегчение. Иногда двойная дуга аорты клинически не проявляется и обнаруживается только во время аутопсии.
Наиболее ценным диагностическим исследованием является рентгенологическое. Томография трахеи, трахеобронхография, контрастирование пищевода (особенно в косых и боковых проекциях) позволяют правильно распознать порок. Кинотрахеограмма помогает выявить необычные движения трахеи и моменты её коллапса. При расположении грудной части аорты справа или слева пищевод может располагаться контрлатерально. В затруднительных случаях показана бронхоскопия и ретроградная аортография.
Лечение только оперативное. Показания к нему определяются степенью сдавления трахеи и пищевода. Операция направлена на рассечение сосудистого кольца и высвобождение трахеи и пищевода. Так, при наличии двойной дуги одну из дуг (с меньшим диаметром) пересекают и накладывают сосудистый шов (смотри полный свод знаний). Точно такую же операцию производят при обнаружении артериального протока или его рудимента. Подключичную артерию, аномально проходящую позади пищевода и трахеи, отсекают и подшивают без натяжения к левой общей сонной артерии так, чтобы расширить сосудистое кольцо.
Исходы операций, как правило, благоприятные.
Аномалии коронарных артерий. Отхождение коронарных артерий от лёгочного ствола приводит к ишемии миокарда и сердечной недостаточности вскоре после рождения. Чаще правая коронарная артерия имеет нормальное положение и снабжает миокард через коллатерали. Кровоток в аномально отходящей левой коронарной артерии направлен ретроградно, в лёгочный ствол. Этот лево-правый шунт, как правило, небольшой. Левый желудочек дилатирован и фиброзно изменён, имеет парадоксальные сократительные движения и слабую сократительную способность. Во время физических нагрузок, даже малых, возникают типичные приступы стенокардии (смотри полный свод знаний). Сердце постепенно увеличивается. При инфаркте сосочковых мышц и развитии митральной недостаточности появляется интенсивный систолический шум. На ЭКГ характерные признаки ишемической болезни сердца (смотри полный свод знаний) или инфаркта миокарда (смотри полный свод знаний). Рентгенологические изменения: кардиомегалия, резкий венозный застой в лёгких. При катетеризации сердца и особенно при контрастном исследовании аорты и левого желудочка обнаруживаются только правая коронарная артерия, большой остаточный диастолический объем желудочка и его слабая сократительная деятельность. Иногда на снимках становится видимой левая коронарная артерия.
Лечение оперативное: производят наложение аортокоронарного шунта с левой коронарной артерией, которую у самого устья перевязывают. Более перспективной операцией считают анастомозирование левой подключичной артерии с аномальной коронарной артерией. Однако эти операции не улучшают функции левого желудочка.
Аномалии расположения сердца подразделяют на эктопии сердца и аномалии его внутригрудного расположения. К эктопиям сердца относят дислокацию, при которой часть сердца или все оно располагается внутри или вне средостения (смотри полный свод знаний); наблюдаются и другие эктопии: шейные, торакальные, торакоабдоминальные, абдоминальные. Смещённое сердце, покрытое перикардом или без него, может быть расположено на поверхности тела (при торакальной эктопии) или внутри серозной полости (при брюшной эктопии). Наиболее часто наблюдаются грудные эктопии, реже брюшные и очень редко шейные. Обычно эктопия сердца сопровождается другими Пороки сердца врождённые (дефекты перегородок, тетрада Фалло, полная транспозиция и другие), а также неправильным расположением брюшных органов.
Согласно классификации Института сердечно-сосудистой хирургии имени акад. А. Н. Бакулева аномалии расположения сердца подразделяют в зависимости от локализации правого (венозного) предсердия, верхушки сердца, брюшных органов, а также пространственных соотношений желудочков сердца и предсердий. Расположение венозного предсердия определяется по отношению к средней линии и левому (артериальному) предсердию; в зависимости от этого сердце может быть право или лево-сформированным. Положение верхушки сердца по отношению к средней линии тела характеризуется как право или лево-расположенное. Таким образом, нормальное сердце обозначается как право-сформированное лево-расположенное. Согласно этому подразделению возможны 7 основных сочетаний аномального расположения сердца.
Клинические, проявления порока могут быть различными. Обычно аномалии расположения сердца сами по себе не вызывают существенных нарушений в гемодинамике, однако их частные сочетания с другими Пороки сердца врождённые обусловливают патологический нарушения.
Распознавание аномалии несложное, затрудняют диагностику только сопутствующие Пороки сердца врождённые
Основная задача оперативного вмешательства при эктопии — погружение сердца, фиксированного магистральными сосудами, в брюшную или грудную полость и ликвидация Пороки сердца врождённые
Исходы без оперативного вмешательства неудовлетворительные, хотя известны казуистические случаи эктопии сердца у взрослых. Риск оперативного вмешательства очень высокий.
Аномалия Тауссиг — Бинга — врождённый порок сердца, при котором аорта отходит от правого желудочка, а лёгочный ствол от обоих желудочков, как бы сидя верхом на дефекте межжелудочковой перегородки (над межжелудочковой перегородкой). Характерна резкая лёгочная гипертензия, гипоксемия. В раннем детском возрасте оперативное лечение сводится к суживанию лёгочного ствола (смотри полный свод знаний: Тауссиг — Бинга синдром).
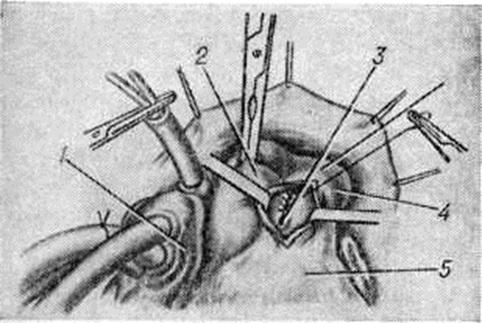
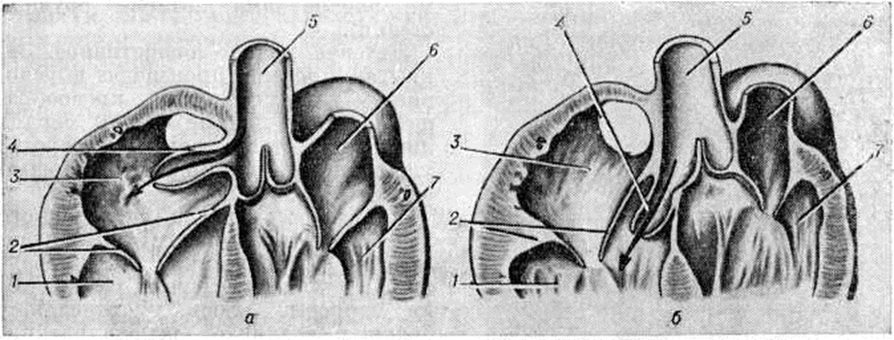
Аномалия Эбштейна — смещение створок трёхстворчатого клапана в глубь правого желудочка с деформацией, недоразвитием и распластыванием их по внутренней стенке правого желудочка, который разделяется смещёнными створками на две части, и сопровождающееся увеличением диаметра фиброзного кольца, а также полости правого предсердия (рисунок 1,6). Лечение оперативное: протезирование трёхстворчатого клапана с ликвидацией предсердной части правого желудочка (смотри полный свод знаний: Эбштейна аномалия).
Аномальное впадение лёгочных вен — врождённый порок сердца, при котором все вены лёгкого соединяются не с левым предсердием, а впадают в венозную систему большого круга кровообращения. Порок встречается в 1,6—2% случаев среди всех Пороки сердца врождённые, одинаково часто у лиц мужского и женского пола. Возникновение аномалии связано с нарушением в первые 3 месяцев эмбриологические развития общей лёгочной вены, которая в норме дифференцируется и соединяется с левым предсердием.
При этом пороке вены правого и левого лёгкого впадают позади сердца в коллектор, который соединяется с плечеголовными или другими венами груди или живота. Существует четыре типа впадения вен. Надкардиальный тип (наиболее часто встречающийся) — коллектор открывается слева, через аномальную вертикальную вену в плечеголовную вену. Кардиальный тип (занимает второе место по частоте) — коллектор соединяется с коронарным синусом, реже с правым предсердием. Подкардиальный (точнее — поддиафрагмальный тип) — коллектор соединяется через аномальный сосуд, проходящий рядом с пищеводом под диафрагму, с верхней или нижней полой веной. Смешанный тип — вены правого и левого лёгкого могут образовать два и более коллектора, соединяющихся с правым предсердием.
Обязательным условием сохранения жизни является наличие открытого овального окна в межпредсердной перегородке или её дефекта. Обычно размеры сообщения небольшие, вследствие чего большая часть больных детей с таким пороком погибает на первом году жизни. Правые отделы сердца гипертрофированы и дилатированы, левые — гипоплазированы или нормальны.
Артериальная и венозная кровь (из большого круга кровообращения) поступает в правое предсердие, смешивается, и часть её направляется через имеющийся дефект межпредсердной перегородки в левые отделы сердца и аорту. Степень цианоза всецело зависит от количества артериальной крови, поступающей через дефект межпредсердной перегородки (обратно пропорциональна объёму циркулирующей через лёгочные сосуды крови). Выделяют три варианта нарушений гемодинамики. 1. Более чем в половине случаев наблюдается затруднение оттока легочно-венозной крови в правое предсердие. Давление в лёгочном стволе высокое (на 50% превышает аортальное). Лёгочный кровоток почти соответствует кровотоку по большому кругу кровообращения. 2. Ок. 20% больных имеют лёгочную гипертензию при отсутствии затруднений в оттоке венозной крови. Минутный объем малого круга кровообращения превышает минутный объем большого круга кровообращения более чем в два раза, легочно-капиллярное давление ниже 15 миллиметров ртутного столба. 3. Приблизительно у 25% больных лёгочная гипертензия не развивается, отсутствуют затруднения в лёгочном кровотоке, цианоз незначительный.
Клиническая картина во многом определяется величиной минутного объёма малого круга кровообращения, степенью лёгочной гипертензии (смотри полный свод знаний: Гипертензия малого круга кровообращения) и величиной сброса артериальной крови через дефект межпредсердной перегородки. У 25% больных, имеющих значительный дефект межпредсердной перегородки, большой минутный объем большого круга кровообращения без лёгочной гипертензии, цианоз минимальный, общее состояние относительно удовлетворительное. Приблизительно у 60% больных с затруднениями лёгочного кровотока и нарушениями гемодинамики (поддиафрагмальном, надкардиальном и смешанном типах) наблюдаются выраженный цианоз, явления сердечной недостаточности (смотри полный свод знаний), приступы одышки. Дети плохо развиваются, часто теряют сознание. Выражен верхушечный толчок. Увеличена печень. При выслушивании обнаруживают резко усиленный II тон, как правило, шумов нет. В лёгких иногда выслушиваются хрипы.
Примерно у 15% больных (с признаками гиперкинетической лёгочной гипертензии без нарушений в возврате лёгочной крови) уже на первом году жизни отмечаются сердечная недостаточность, цианоз, тахипноэ, отставание в физическом развитии, частые респираторные заболевания. Выражен верхушечный толчок, увеличены сердце и печень. II тон широко расщеплен, его лёгочный компонент усилен. Над лёгочной артерией лёгкий систолический шум.
На ЭКГ имеются признаки гипертрофии правого желудочка и правого предсердия. При рентгенологическое исследовании только у больных с надкардиальным типом нарушения гемодинамики в области основания сердца обнаруживается характерная дополнительная округлая тень (в переднезадней проекции имеет вид восьмёрки). Резкое усиление лёгочного рисунка сочетается с относительно небольшим увеличением размеров сердца. У больных с лёгочной гипертензией сердце большое, особенно увеличены его правые отделы.
При катетеризации сердца катетер удаётся провести через дефект межпредсердной перегородки в левое предсердие. Градиент давления между предсердиями может достигать 3 миллиметров ртутного столба и более (в правом предсердии выше, чем в левом). Измерение давления в лёгочном стволе указывает на гипертензию. Увеличение легочно-альвеолярного давления (выше 15 миллиметров ртутного столба) часто обусловлено затруднением возврата лёгочной крови. Оксигенированную кровь обнаруживают уже в верхней полой вене (или в нижней — при поддиафрагмальном типе порока).
Нередко полученные данные чрезвычайно трудно трактовать. Основная задача контрастного исследования — выявление аномалии «лёгочного возврата». Провести катетер в коллектор лёгочных вен практически не удаётся, поэтому наилучшим методом является введение контрастного вещества в лёгочную артерию.
Дифференциальную диагностику проводят с тетрадой Фалло (смотри полный свод знаний: Фалло тетрада), транспозицией крупных сосудов, дефектом межжелудочковой перегородки, дефектом межпредсердной перегородки, протекающим с небольшим цианозом.
Лечение оперативное. Больных оперируют в условиях искусственного кровообращения и глубокой гипотермии. У некоторых новорождённых целесообразна баллонная септостомия, проводимая с паллиативными целями во время катетеризации сердца, то есть создание дефекта межпредсердной перегородки с помощью вводимого катетера, имеющего раздуваемый баллончик. У детей и взрослых с надкардиальным и под диафрагмальным типами порока на «открытом» сердце накладывают широкий анастомоз венозного коллектора с левым предсердием. При кардиальном типе порока на широкое отверстие коронарного синуса и дефект межпредсердной перегородки накладывают заплату, благодаря чему вся кровь коронарного синуса, включая и лёгочную, направляется в левое предсердие. Если же часть лёгочных вен впадает непосредственно в правое предсердие, то производят перемещение межпредсердной перегородки.
Исходы. Без оперативного вмешательства 80% новорождённых погибает в течение первого года жизни, а выжившие нуждаются в лечении сердечной недостаточности.
Послеоперационная летальность у новорождённых и грудных детей — 30—50% (чаще такой исход наблюдается при поддиафрагмальном и смешанном пороке и высокой лёгочной гипертензии); в раннем детском возрасте и у взрослых — 5—8%. В послеоперационном периоде часто возникают осложнения со стороны дыхания и сердечной деятельности, связанные с малым сердечным выбросом. Результаты в отдалённые сроки, как правило, хорошие.
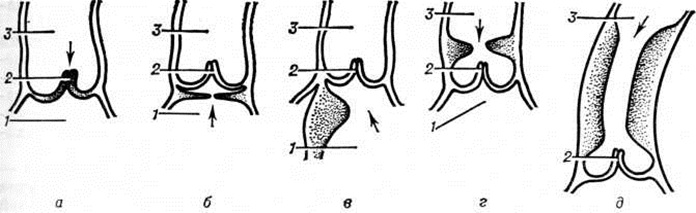
Аортальный стеноз. Среди всех Пороки сердца врождённые отмечается в 5—10% случаев, причём в 20% он сочетается с другими пороками — открытым артериальным протоком (смотри полный свод знаний), коарктацией аорты (смотри полный свод знаний), дефектом межжелудочковой перегородки, стенозом лёгочного ствола, эндокардиальным фиброэластозом (смотри полный свод знаний: Фиброэластоз субэндокардиальный). Выделяют четыре вида стеноза (рисунок 2): клапанный (наиболее частый), подклапанный, надклапанный стеноз и асимметричную перегородочную гипертрофию. Надклапанный аортальный стеноз часто сочетается с нарушениями метаболизма витамина D и идиопатической гиперкальциемией (смотри полный свод знаний). Асимметричная перегородочная гипертрофия в ⅛ случаев наблюдается у родственников.
Аортальный стеноз приводит к повышению давления в левом желудочке; между ним и аортой возникает градиент давления, величина которого пропорциональна степени обструкции. Во время физических нагрузок для поддержания соответствующего кровотока необходимы огромные усилия левого желудочка для его опорожнения и требуется более продолжительная систола. При этом возрастает потребность миокарда в кислороде. Период диастолы укорачивается, а следовательно, коронарная перфузия редуцируется. На фоне гипертрофии миокарда возникает его ишемия, снижаются скоростные показатели сердца, прежде всего страдает диастола, что приводит к падению насосной функции сердца. Если градиент давления между левым желудочком и аортой менее 60 миллиметров ртутного столба сердце справляется с нагрузками, сердечная недостаточность, как правило, не развивается.
При асимметричной перегородочной гипертрофии в отличие от других видов аортального стеноза патофизиологические изменения зависят от тонуса и сократительных свойств миокарда и левожелудочкового конечно-диастолического давления.
Более половины случаев аортального стеноза — изолированный клапанный стеноз (рисунок 2, а), при котором створки клапана утолщены, фиброзно изменены, сращены по комиссурам. Фиброзное кольцо не изменено, хотя может быть и гипоплазировано. При сращении трёх комиссур центральное отверстие остаётся суженным, сращение правой и левой створок приводит к образованию двустворчатого клапана с эксцентричным узким отверстием, что встречается в 60—80% случаев. В клапане сохраняются признаки эмбриональной соединительной ткани. При крайней степени стеноза иногда наблюдаются фиброзные изменения миокарда, некрозы сосочковых (папиллярных) мышц и фиброэластоз. Кальциноз обычно развивается у взрослых (после 30 лет) и крайне редко у детей.
Подклапанный стеноз (рисунок 2, б) занимает второе место по частоте; он представляет собой фиброзную мембрану, расположенную на 10—15 миллиметров ниже клапана аорты. Отверстие в мембране может располагаться центрально, но чаще мембрана выступает с вентральной стороны выходного тракта желудочка и срастается с передней створкой митрального клапана (рисунок 1, в). Аортальный клапан при этом не сужен, хотя створки его могут быть утолщены, что сопровождается незначительной регургитацией. Изменения клапана связывают с турбулентным током крови. В изменённом клапане легко возникает инфекционные процесс, приводящий к развитию бактериального эндокардита (смотри полный свод знаний).
Надклапанный аортальный стеноз (рисунок 2, г, д) — сужение сразу над комиссурами либо гипоплазия фиброзного кольца и восходящей части аорты. Стенка сосуда в месте сужения состоит из фиброзной ткани и эластических волокон, распространяющихся из средней оболочки. Эти изменения могут достигать устьев коронарных (венечных) сосудов и вызывать их сужение. Надклапанный стеноз нередко сочетается с периферическими сужениями правой и левой лёгочных артерий, аномалиями аортального клапана и коронарных артерий.
Асимметричная перегородочная гипертрофия (мышечный субаортальный стеноз) — диффузное увеличение мышечной массы, распространяющееся на несколько сантиметров ниже клапана (рисунок 2, в).
Клиническая картина не зависит от вида аортального стеноза и определяется исключительно степенью сужения. Значительная часть детей со стенозом развивается нормально. При выраженном стенозе наблюдаются одышка, загрудинные боли и внезапная асистолия при физических нагрузках. У новорождённых с резко выраженным стенозом, если они не погибают сразу после родов, очень быстро развиваются сердечная недостаточность (смотри полный свод знаний), расстройства дыхания. Для порока характерно малое пульсовое давление, усиленный верхушечный толчок, систолическое дрожание и грубый интенсивный систолический шум в проекции клапана аорты, проводящийся на шею. Сердце может быть не увеличенным. При развитии сердечной недостаточности шумы ослабевают (уменьшается производительность сердца), наблюдаются тахипноэ, кардиомегалия, гепатомегалия, ухудшается периферическое кровообращение, усиливается пульсация правого желудочка.
 |
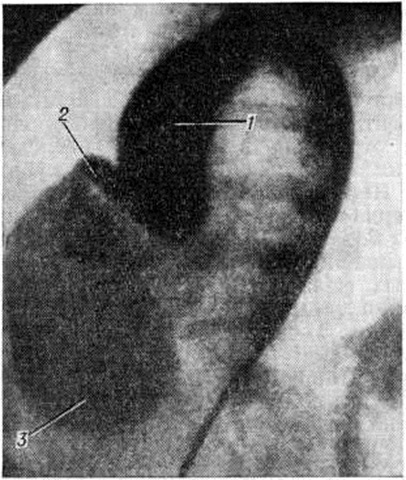
|  |
Рис. 3. | ||
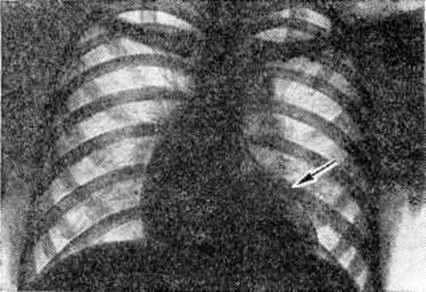
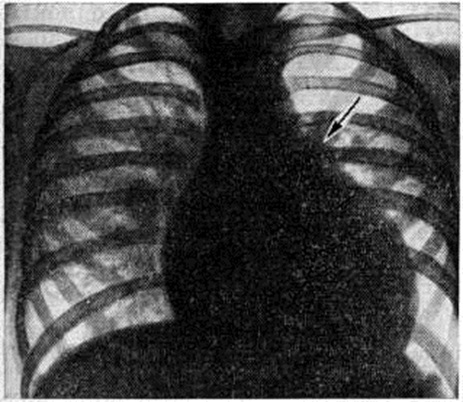
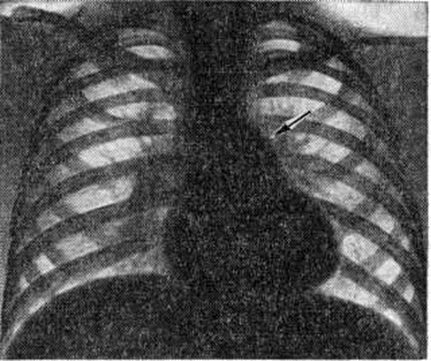
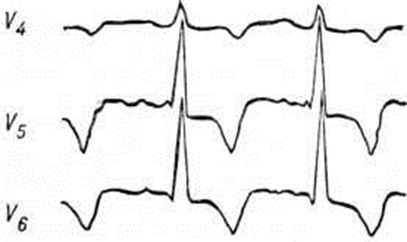
Диагноз. При аортальном стенозе данные векторкардиографии (смотри полный свод знаний) отражают подъём левожелудочкового давления лучше, чем ЭКГ. Только заметное повышение давления (градиент давления на уровне сужения более 60 миллиметров ртутного столба) приводит к появлению на ЭКГ признаков гипертрофии левого желудочка. У новорождённых на ЭКГ могут быть лишь признаки гипертрофии правого желудочка. Характерные клинические, симптомы в сочетании с признаками гипертрофии левого желудочка на ЭКГ указывают на выраженный аортальный стеноз (рисунок 3).
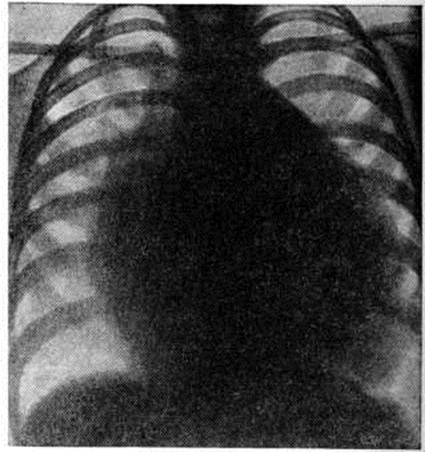
При рентгенологическое исследовании у детей тень сердца нормальных размеров или с признаками гипертрофии левого желудочка. При высоком конечно-диастолическом давлении в левом желудочке и левом предсердии отмечаются застойные явления в прикорневых отделах лёгких. Может быть расширена восходящая часть аорты (постстенотическая дилатация). У детей с выраженным стенозом рентгенологически определяется аортальная конфигурация сердца (рисунок 4) и усиленный легочно-сосудистый рисунок.
При ретроградной катетеризации сердца катетер проводят через место сужения в полость левого желудочка, измеряют градиент давления, выявляют место сужения и возможные сопутствующие пороки. У новорождённых и грудных детей катетеризация сердца может быть заменена эхокардиографическим исследованием (смотри полный свод знаний: Эхокардиография).
У больных с асимметричной перегородочной гипертрофией во время систолы происходит смыкание передней створки левого предсердножелудочкового (митрального) клапана с гипертрофированным миокардом. Сужение может сопровождаться большим градиентом давления. При нагрузках, приёме сердечных гликозидов или инотропных средств и нитроглицерина градиент давления возрастает, но снижается при использовании р-адреноблокаторов (анаприлина, обзидана, индерала). Во время систолы, следующей после экстрасистолы, артериальное давление уменьшается, в то время как при других видах аортальногостеноза оно возрастает. При массивной мышечной гипертрофии возникает обструкция выходного отдела левого желудочка, нарушается функция митрального клапана. Признаки заболевания аналогичны таковым при других видах аортального стеноза, однако на ЭКГ всегда регистрируют выраженную гипертрофию левого желудочка, удлинение интервала Q — Г, изменения S — Г, зубцов Т и Q. Диагноз может быть установлен достаточно точно с помощью эхокардиографии. Во время катетеризации сердца на киноангиокардиограмме (смотри полный свод знаний: Ангиокардиография) в боковой проекции видно сужение полости левого желудочка в его выходной части.
Детей с сердечной недостаточностью оперируют по жизненным показаниям. Так называемый плановые операции при аортальном стенозе выполняют, если в покое градиент давления на уровне сужения выше 60 миллиметров ртутного столба.
Аортальную вальвулотомию производят либо по закрытой методике (через верхушку сердца в аорту последовательно проводят вальвулотом и дилататор), либо на «открытом» сердце в условиях умеренной гипотермии (общей или краниоцеребральной) при пережатых полых венах. Доступ — через стенку аорты. В течение 3—5 минут рассекают клапан по комиссурам. Безопаснее устранять порок в условиях искусственного кровообращения. Наибольшие трудности возникают при коррекции надклапанного сужения с гипоплазией аорты, что требует вшивания заплаты в стенку аорты, иногда с протезированием клапанов сердца (смотри полный свод знаний), и асимметричной гипертрофии миокарда. Иссечение мышечных масс может быть выполнено из аортального доступа, который иногда приходится дополнять рассечением стенки левого желудочка. Существуют методики, предусматривающие иссечение миокарда со стороны правого желудочка. К более радикальным операциям относится иссечение миокарда через левое предсердно-желудочковое отверстие с последующим протезированием митрального клапана.
Ок. 10% неоперированных детей раннего возраста имеют явные признаки левожелудочковой недостаточности. В течение первого года жизни (особенно первого месяца) большая их часть погибает. У выживших со средней степенью сужения клинические, признаки Пороки сердца врождённые с возрастом нарастают. Страдающие тяжёлой формой стеноза в 1—7% случаев умирают внезапно. В 20% случаев при стенозе развивается регургитация. При асимметричной гипертрофии перегородки сердца продолжительность жизни ограничена 40—50 годами.
Результаты оперативного лечения во многом определяются исходной степенью тяжести стеноза, его морфологией, состоянием миокарда левого желудочка, радикальностью оперативного вмешательства и отсутствием послеоперационной недостаточности клапана. Операционная летальность не превышает 10%. Через 10 лет около 25% оперированных нуждается в повторном вмешательстве для ликвидации рестеноза или регургитации. Во время повторных операций, как правило, производят протезирование клапана. У остальных отдалённые результаты хорошие и удовлетворительные: большая часть из них может считаться практически здоровыми.
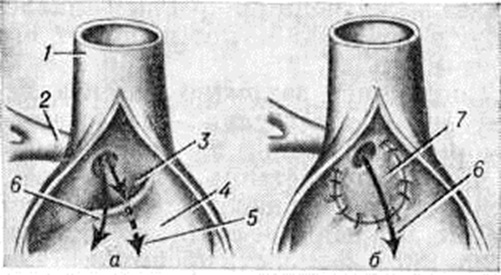
Аортолёгочный свищ — врождённое соустье между восходящей частью аорты и лёгочным стволом — относится к редким аномалиям (0,3% всех врождённых пороков «сердца.).
На 8-й неделе у эмбриона формируется спиральная перегородка, которая при нормальном развитии делит общий артериальный ствол на два продольных канала (аорту и лёгочный ствол) и срастается в области их фиброзных колец с межжелудочковой перегородкой. Нарушения механизма образования перегородки приводят к появлению патологический отверстия между двумя магистральными сосудами.
В большинстве случаев дефект располагается на 1—5 миллиметров выше фиброзного кольца устья аорты. Реже отверстие достигает клапанов аорты и лишь иногда располагается в дистальной х/3 восходящей части аорты. Размеры соустья варьируют широко — от 2 до 30 миллиметров. Отсутствие межсосудистой перегородки от клапанов аорты до дистального отдела восходящей части аорты может рассматриваться как общий артериальный ствол.
Характер гемодинамических нарушений при аортолёгочном свище во многом сходен с расстройствами кровообращения при открытом артериальном протоке. Однако вследствие близости патологический отверстия к устью аорты (отверстие аорты) осложнения развиваются быстрее, в частности лёгочная гипертензия.
Клиническая картина определяется размерами аортолёгочного свища и состоянием сосудов лёгких. При небольших размерах свища (менее 5 миллиметров) течение порока аналогично таковому при артериальном протоке. Однако эпицентр систолодиастолического шума при этом пороке располагается ближе к средней линии во втором межреберье у грудины. При средних размерах свища (6—10 миллиметров) клинические, проявления более тяжёлые, чем при артериальном протоке такого же диаметра. Отмечается бледность, ребёнок отстаёт в физическом развитии, у него легко возникает одышка, даже при небольших физических нагрузках; характерны слабость, повышенная утомляемость. Большой свищ (более 10 миллиметров) сопровождается высокой лёгочной гипертензией, поэтому возникновение цианоза, приступов одышки, нарушений ритма (вначале лишь при нагрузках) свидетельствует о выравнивании давления в аорте и лёгочном стволе и двустороннем шунтировании крови. В этот период может проявиться сердечная недостаточность.
До развития лёгочной гипертензии (при малых и средних размерах свища) клинические, признаки порока во многом совпадают с проявлениями артериального протока (систолодиастолический шум, дрожание над сердцем и другие). При развитии лёгочной гипертензии вначале исчезает диастолический шум, а затем ослабевает и систолический.
На ЭКГ в зависимости от степени нарушений гемодинамики определяются признаки перегрузки левого, обоих или преимущественно правого желудочка, нарушения сердечного ритма (пароксизмальная тахикардия, экстрасистолия).
При рентгенологическое исследовании — изменения размеров сердца и сосудов лёгких взаимосвязаны с величиной и направлением сброса крови. При большом артериовенозном сбросе увеличены основание и левые отделы сердца, усилен лёгочный рисунок, выбухает дуга лёгочного ствола; при сбалансированном шунте наблюдается гипертрофия обоих желудочков, обеднение сосудистого рисунка по периферии лёгких.
Катетеризация и контрастирование сердца являются основными методами распознавания порока и установления степени нарушений гемодинамики. Катетер, проведённый из правого желудочка в лёгочный ствол, может попасть через свищ в аорту. В зависимости от величины давления в аорте и лёгочном стволе контрастирование одной из них может дать полное представление о локализации, размерах, направлении и объёме шунта. Для этой цели производят аортографию (смотри полный свод знаний) в прямой и правой косой позиции (с помощью катетера, проведённого ретроградно до клапана аорты). Величина сброса крови может быть установлена также исследованием её на насыщение кислородом в различных участках правых отделов сердца и лёгочном стволе красочными, платиноводородными и термодилюционными пробами.
Порок следует дифференцировать с открытым артериальным протоком (смотри полный свод знаний), дефектом межжелудочковой перегородки, стенозом лёгочной артерии, стенозом устья аорты, недостаточностью митрального клапана, разрывом аневризмы синуса Вальсальвы, аневризмами коронарных сосудов, артериовенозными аневризмам левой внутригрудной, межрёберных артерий или перикардиальных сосудов.
Лечение оперативное, за исключением больных с выраженной лёгочной гипертензией и преобладающим венозно-артериальным сбросом крови (им показано ограничение в физических нагрузках и терапия сердечной недостаточности).
Для закрытия свища существует несколько способов. Свищ, расположенный выше аорты и клапанов лёгочного ствола, перевязывают несколькими лигатурами. Если свищ прилегает к клапану аорты, то его можно ушить со стороны лёгочного ствола (рисунок 5) в условиях умеренной гипотермии с выключением сердца из кровообращения. В большинстве же случаев операция при аортолёгочном свище проводится в условиях искусственного кровообращения. В зависимости от размеров отверстия и продолжительности операции применяется один из видов защиты миокарда (холодовая или медикаментозная кардиоплегия, коронарная перфузия и тому подобное). При дистально пережатых сосудах производят либо ушивание свища, либо вшивание заплаты (что предпочтительно) со стороны аорты или лёгочного ствола.
Неоперированные больные с лёгочной гипертензией обычно погибают в детском возрасте. Летальность после операций у больных без выраженной лёгочной гипертензии не превышает 5%, у больных с лёгочной гипертензией более 50%. Результаты в отдалённые сроки после операции в подавляющем большинстве случаев благоприятные.
Артериальный проток соединяет аорту с лёгочным стволом. Необходимый в период эмбрионального развития для нормального кровообращения, после рождения ребёнка он облитерируется. Если облитерация не наступает, развиваются нарушения гемодинамики, сброс крови из аорты в лёгочный ствол. Лечение оперативное (смотри полный свод знаний: Артериальный проток).
Атрезия лёгочного ствола в сочетании с дефектом межжелудочковой перегородки представляет собой одну из форм тетрады Фалло. Обычно наблюдается гипоплазия правого желудочка (I тип); возможно сочетание нормального или даже расширенного правого желудочка с несостоятельностью трёхстворчатого клапана (II тип).
Клапан лёгочного ствола маленький, заращён. Дистальнее его ствол сосуда сохранен. Центральный кровоток осуществляется через дефект перегородки в левые отделы сердца и аорту, далее через артериальный проток в сосуды лёгких. Артериальный проток обычно узкий. Степень цианоза зависит от величины сброса крови через артериальный проток. Цианоз заметен с момента рождения, усиливается с развитием сердечной недостаточности; наблюдаются приступы гипоксии, ацидоз.
На ЭКГ отмечаются признаки преобладания левого желудочка, особенно при I типе порока. Рентгенологические исследование выявляет увеличение размеров сердца, лёгочно-сосудистый рисунок ослаблен. При контрастировании сердца виден правый желудочек с выходным отделом в виде слепого мешка и регургитацией в предсердие.
Этот порок нужно дифференцировать с трикуспидальной атрезией, тетрадой Фалло, стенозом лёгочного ствола, транспозицией крупных сосудов со стенозом лёгочного ствола.
Лечение оперативное. Если правый желудочек недоразвит, то целесообразно наложить межсосудистый анастомоз; если он развит нормально, то производят лёгочную вальвулотомию. В некоторых случаях между правым желудочком и лёгочным стволом вшивают кондуит (консервированный в глутаровом альдегиде биологический трансплантат клапана сердца, вшитый в сосудистый протез).
Послеоперационная летальность у новорождённых с гипоплазированным правым желудочком высокая (до 80%). Без операции практически все дети погибают в течение первого года жизни.
Атрезия устья аорты сочетается с гипоплазией восходящей части аорты, гипоплазией или атрезией левого желудочка и атрезией или выраженным стенозом митрального клапана. Устья коронарных артерий, как правило, располагаются в луковице аорты. Для поддержания жизни необходимы артериальный проток и дефект межпредсердной перегородки (открытое овальное окно). Кровообращение при этом происходит следующим образом: венозная кровь большого и малого круга кровообращения смешивается в предсердии, поступает в правый желудочек, лёгочный ствол и через артериальный проток в аорту.
Аортальная атрезия и другие варианты гипоплазии левых отделов сердца являются самой частой причиной смерти новорождённых с Пороки сердца врождённые Хотя при рождении ребёнок может выглядеть нормально, вскоре выявляется сердечная недостаточность с дилатацией правого желудочка, падением АД и цианозом. Данные физикального, электрокардиографического и рентгенологическое исследований далеко не всегда позволяют правильно распознать порок. Только эхокардиография, катетеризация сердца и киноангиокардиография дают возможность поставить окончательный диагноз и оценить гемодинамические нарушения. Порок считается неизлечимым, оперативное вмешательство не проводится. Большая часть новорождённых с этой патологией погибает в течение нескольких дней после рождения.
Атриовентрикулярный канал (неполная форма) представляет собой сочетание первичного дефекта межпредсердной перегородки с расщеплением створки митрального или трёхстворчатого клапана или створок обоих клапанов.
Первичный дефект межпредсердной перегородки всегда большой, имеет полулунную форму, сверху отграничен межпредсердной перегородкой, снизу фиброзным кольцом клапанов. Передняя створка митрального клапана расщеплена обычно в середине общей части фиброзного кольца клапана. Аналогично может быть изменена и перегородочная створка трёхстворчатого клапана..
Нарушения гемодинамики аналогичны таковым при первичном дефекте межпредсердной перегородки. Расщепление створки клапана приводит к регургитации крови из желудочка (или обоих желудочков) в оба предсердия; степень регургитации может быть различной.
Для детей в возрасте до 3 лет при этом пороке характерна сердечная недостаточность, которая сопровождается одышкой, низкой толерантностью к физическим нагрузкам, резким отставанием в развитии ребёнка. У взрослых, как правило, наблюдаются хронический недостаточность кровообращения, приступы пароксизмальной тахикардии, присоединяется инфекционные эндокардит.
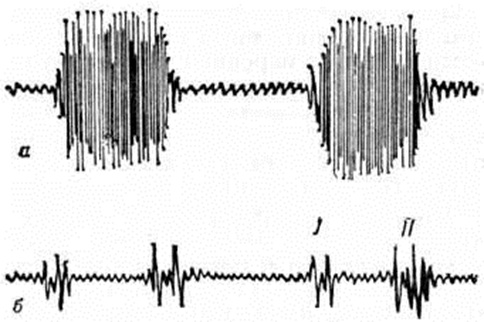
Основные физикальные признаки порока: бледность кожи, «сердечный горб», интенсивный систолический шум над верхушкой сердца, расщепленный 11 тон над лёгочным стволом. На ЭКГ выявляются неполная блокада правой ножки пучка Гиса, отклонение электрической оси влево при наличии диастолической перегрузки правого желудочка; на ФКГ — интенсивный систолический шум над верхушкой сердца, расщепление II тона с усилением лёгочного компонента. Рентгенологически отмечается увеличение обоих желудочков, нередко кардиомегалия. При катетеризации сердца обнаруживают низкий дефект межпредсердной перегородки и регургитацию из желудочка при заполнении его контрастным веществом.
Лечение — оперативное: из правосторонней торакотомии (смотри полный свод знаний) или срединной стернотомии (смотри полный свод знаний: Медиастинотомия) в условиях искусственного кровообращения расщепленную створку клапана соединяют отдельными П-образными швами, стремясь не сузить клапан. Дефект межпредсердной перегородки закрывают заплатой.
 |
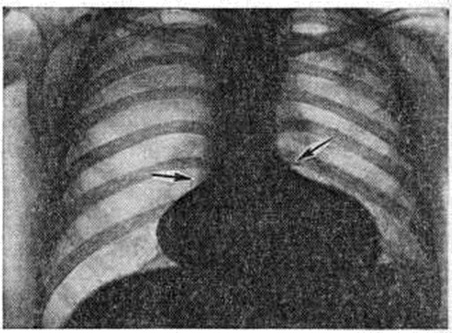
|  |
Рис. 7. | ||
Послеоперационная летальность до 7%. Более чем у половины оперированных сохраняется слабый систолический шум вследствие незначительной регургитации из желудочка. Ок. 80% пациентов в отдалённые сроки после операции практически здоровы.
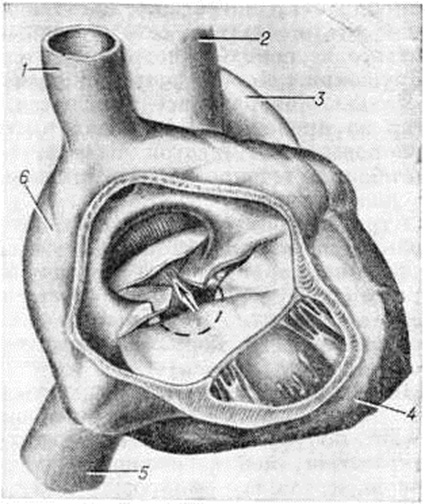
Атриовентрикулярный канал (полная форма). Полный атриовентрикулярный канал (рисунок 6) — сложный Пороки сердца врождённые, при котором, кроме первичного дефекта межпредсердной перегородки и расщепления створок клапанов, имеется и дефект межжелудочковой перегородки, создающий с дефектом межпредсердной перегородки единое отверстие.
Этот порок характеризуется преимущественно аномалиями створок клапанов, наличием общего атриовентрикулярного отверстия и подстворочного дефекта различных размеров в межжелудочковой перегородке (рисунок 1, г). Очень редко дефект межпредсердной перегородки закрывается, а аномалия представляет собой сочетание расщепления створки с дефектом межжелудочковой перегородки. Крайняя форма полного атриовентрикулярного канала — большой первичный дефект межпредсердной перегородки, переходящий в большой дефект межжелудочковой перегородки, и единый атриовентрикулярный клапан, в котором половинки правого и левого предсердно-желудочковых клапанов срастаются настолько, что представляют собой переднюю и заднюю створки. При полном атриовентрикулярном канале хорды аномальных створок могут перебрасываться в смежный желудочек, прикрепляться к одной сосочковой мышце.
Нарушение гемодинамики обусловлено регургитацией крови из желудочков в предсердия и артериовенозным шунтированием через патологический отверстие в перегородках сердца.
При полном атриовентрикулярном канале сердечная недостаточность проявляется уже в первые недели или месяцы жизни. Дети плохо развиваются физически, часто страдают инфекционные болезнями. Возникает одышка (даже в покое), резкая утомляемость, печень и сердце увеличиваются. Выслушивается пансистолический шум над верхушкой сердца и по левому краю грудины. При физических нагрузках появляется лёгкий цианоз.
Определяемое расщепление II тона с усилением лёгочного компонента связано с гиперволемией малого круга и блокадой правой ножки пучка Гиса. На ЭКГ — отклонение электрической оси сердца влево. На ФКГ над верхушкой сердца и в четвёртом межреберье слева регистрируется интенсивный систолический шум, связанный с регургитацией крови из желудочков и сбросом крови из левого желудочка в правый. Эхокардиограмма регистрирует необычные движения передней створки митрального клапана, иногда её расщепление и наличие промежутка между ней и межжелудочковой перегородкой. Рентгенологически определяется умеренная или значительная кардиомегалия и дилатация лёгочного ствола (рисунок 7).
При катетеризации сердца катетер легко проникает во все его отделы. В правом предсердии обнаруживается артериальная кровь, давление в нем и лёгочном стволе повышено. Отмечается высокое сопротивление лёгочных сосудов. При рентгеноконтрастном исследовании определяется деформация митрального клапана, попадание контрастного вещества в правые отделы сердца, левое предсердие, а также деформация выходного отдела левого желудочка.
Лечение лёгочной гипертензии в раннем детском возрасте оперативное: сужение лёгочного ствола; эта паллиативная операция не всегда даёт положительный результат. Радикальная операция, проводимая в условиях искусственного кровообращения, направлена на закрытие дефекта заплатой и восстановление обоих предсердно-желудочковых клапанов. Для проведения коррекции иногда приходится рассекать обе (переднюю и заднюю) створки, чтобы вшить заплату, после чего противолежащие половинки створок фиксируют к заплате и между собой. В тех случаях, когда сухожильные хорды клапана перекидываются в соседний желудочек, для них в заплате оставляют маленькое отверстие или производят иссечение клапана и их протезирование.
Большинство больных с полным атриовентрикулярным каналом погибают в раннем детском возрасте. У выживших развивается сердечная недостаточность, лёгочная гипертензия, часто возникают респираторные заболевания.
После операций главная причина летальных исходов (около 20%) — неадекватная коррекция порока (сохранение регургитации, сброса крови или сердечная недостаточность в результате необратимости лёгочной гипертензии). У выживших практически всегда выслушивается систолический шум, связанный с небольшой регургитацией.
В отдалённые сроки после операции погибает около 10% больных, нередко отмечается остаточная недостаточность либо стеноз митрального или трикуспидального клапана, у 5—10% — полная атриовентрикулярная блокада. Большинство больных чувствуют себя лучше, чем до операции,— уменьшается одышка, они становятся более толерантными к физическим нагрузкам. Уменьшаются размеры сердца и кровенаполнение сосудов лёгких.
Гипоплазия правого желудочка обычно сочетается с атрезией лёгочного ствола, его стенозом и атрезией трёхстворчатого клапана. Очень редко порок бывает изолированным. Он является разновидностью аномалии развития правых отделов сердца (трикуспидальной атрезии, аномалии Эбштейна, стеноза и атрезии лёгочного ствола, тетрады Фалло). Наблюдаются две его морфологический формы: правый желудочек с небольшой полостью, резко гипертрофированной стенкой и изменённым трикуспидальным клапаном; правый желудочек с большой полостью, тонкими фиброзно-перерождёнными стенками и неполноценным трёхстворчатым клапаном.
Показано наложение кавопульмонального или аортолёгочного анастомоза.
Дефекты венозного синуса. При этом Пороки сердца врождённые дефект межпредсердной перегородки локализуется сверху или снизу (полая вена переходит в стенку левого предсердия) и вены лёгкого впадают в верхнюю (нижнюю) полую вену или её устье. Чаще встречаются верхние дефекты венозного синуса. Верхняя полая вена ниже впадения непарной вены значительно расширяется. В неё двумя-тремя стволами вливаются вены верхней доли правого лёгкого, а вены средней доли — в устье полой вены на уровне дефекта перегородки. При нижнем дефекте венозного синуса отмечается транспозиция нижней лёгочной вены вправо, благодаря чему иногда создаётся видимость смещения нижней полой вены в сторону левого предсердия. Отсутствие перегородки между полыми венами со смещением лёгочных вен вправо называют средним дефектом венозного синуса.
Размеры дефекта перегородки — от 0,5 до 2 сантиметров. При нижнем дефекте венозного синуса устье нижней лёгочной вены смещено вправо. Клапан нижней полой вены (евстахиева заслонка) иногда, сливаясь с межпредсердной перегородкой в области коронарного синуса, создаёт условия для тока крови из этой вены в левое предсердие. Задняя стенка нижней полой вены переходит в стенку левого предсердия.
Нарушения гемодинамики аналогичны тем, которые наблюдаются при вторичном дефекте межпредсердной перегородки. Нижний дефект венозного синуса иногда создаёт условия для направления струи крови из нижней полой вены в левое предсердие. Небольшой венозно-артериальный сброс приводит к появлению слабого цианоза и может быть причиной парадоксальной эмболии (попадания венозного тромба в артерии большого круга кровообращения). Эмболия и абсцессы мозга, инфаркты почек и другие осложнения — следствие парадоксальной эмболии. При транспозиции лёгочных вен кровоток в соответствующей части лёгочной ткани усилен (давление в правом предсердии ниже, чем в левом), что сказывается при физических нагрузках. Эффективный газообмен нарастает слабо из-за увеличения балластно-циркулирующей крови.
Клиническая картина характеризуется теми же признаками, что и при вторичном дефекте межпредсердной перегородки.
Данные ЭКГ, ФКГ и рентгенологическое исследования аналогичны таковым при дефекте межпредсердной перегородки. Однако аномальное впадение лёгочных вен в верхнюю полую вену рентгенологически можно заподозрить по необычно высоко расположенному корню правого лёгкого на фоне усиления прикорневого рисунка. При катетеризации сердца катетер проводят в аномальную лёгочную вену и через дефект в межпредсердной перегородке — в левое предсердие. В тех случаях, когда катетер провести не удаётся, применяют транссептальную пункцию с введением контрастного вещества в левое предсердие. Для распознавания места впадения лёгочных вен также производят их контрастирование. Направление движения контрастного вещества выявляет нормальное или аномальное впадение лёгочных вен.
Лечение оперативное. Дефект венозного синуса устраняют либо на «открытом» сердце с помощью заплаты (рисунок 8) или пластики межпредсердной перегородки и задней стенки верхней полой вены, которые подшивают к правому краю аномальных лёгочных вен, либо на работающем сердце путём разделения расширенной верхней полой вены на два канала с последующим подшиванием места деления к нижнему краю дефекта. В последнем случае после коррекции отток легочно-венозной крови осуществляется через сформированный канал верхней полой вены и дефект межпредсердной перегородки в левое предсердие.
Послеоперационная летальность около 1%; в 3—5% случаев наблюдается реканализация дефекта. Отдалённые результаты — 80—90% прооперированных практически здоровы.
Дефект межжелудочковой перегородки. Изолированный дефект межжелудочковой перегородки — наиболее частый Пороки сердца врождённые у новорождённых (30—40%). Клинические, признаки порока были описаны П. Ф. Толочиновым в 1874 год и Роже (Н. L. Roger) в 1879 год (Толочинова—Роже болезнь). Нарушения формирования межжелудочковой перегородки возникают в первые три месяца беременности.
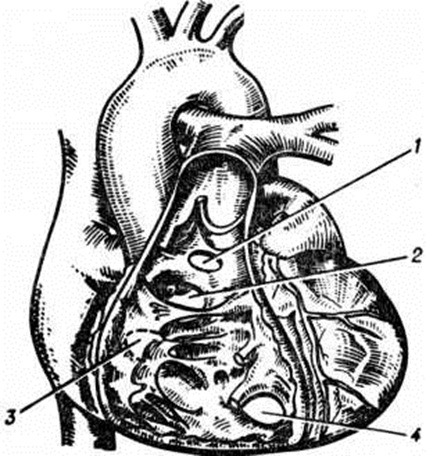
Приблизительно в 85% случаев дефекты располагаются в перепончатой части межжелудочковой перегородки (рисунок 9 и 1, д), то есть непосредственно под правой коронарной и некоронарной створками клапанов аорты (со стороны левого желудочка), на месте перехода передней в перегородочную створку трёхстворчатого клапана под медиальным рогом наджелудочкового гребня межжелудочковой перегородки (со стороны правого желудочка). Иногда дефекты локализуются непосредственно под правой и частично левой полулунными заслонками клапанов аорты (слева), выше наджелудочков ого гребня под клапаном лёгочного ствола (справа). Чаще отверстия располагаются непосредственно под некоронарной створкой клапанов аорты (слева) и под перегородочной створкой трёхстворчатого клапана (справа) вдоль его фиброзного кольца. Ок. 2% случаев — это мышечная локализация дефектов; при этом могут быть и множественные отверстия. Очень редко наблюдается комбинация мышечной и иной локализации дефекта перегородки.
Диаметр дефектов перепончатой части межжелудочковой перегородки варьирует от нескольких миллиметров до 3 см; в основном они круглой или овальной формы. Надгребневые дефекты по величине, как правило, средние и большие (от 7 миллиметров до 2 сантиметров) и также круглые; примыкающие к клапанам аорты и лёгочного ствола — более сложной формы. Дефекты вблизи трёхстворчатого клапана, расположенные вдоль его фиброзного кольца, имеют размеры от нескольких миллиметров до 3—4 сантиметров, форма их различна — от круглой до продольной, от полулунной до треугольной. Мышечные дефекты обычно круглые и небольшие. В кардиохирургии размеры дефекта определяются их отношением к диаметру аорты (средние по величине дефекты имеют в диаметре от ¼ до ½ диаметра аорты). Самые большие дефекты простираются от наджелудочкового гребня вниз и кзади вдоль фиброзного кольца под перегородочную и даже заднюю створки трёхстворчатого клапана. Иногда полностью отсутствует верхняя часть межжелудочковой перегородки и аорта открывается как бы в оба желудочка. Края маленьких дефектов обычно покрыты фиброзной тканью, средних и больших — мышечной (там, где отверстие не примыкает к устью клапанов).
Проводящая система сердца (смотри полный свод знаний) — пучок Гиса и его ножки — при высоких подгребневых дефектах проходит по нижнезаднему краю дефекта под эндокардом (со стороны левого желудочка); при задних подстворочных дефектах расположение пучка непостоянное — либо по задне-верхнему, либо по задненижнему краю отверстия.
При непосредственной близости средних и больших дефектов к фиброзному кольцу клапанов аорты из-за отсутствия достаточной опоры возникает недостаточность клапанов. Так, при локализации дефекта в перепончатой части перегородки или над наджелудочковым гребнем может возникнуть пролабирование полулунной заслонки клапанов аорты в полость правого желудочка с появлением аортальной регургитации различной степени.
В некоторых случаях существование артериовенозного сброса рано приводит к гипертрофии правого желудочка, преимущественно его выходного отдела. Увеличение массы наджелудочкового гребня и передней стенки желудочка формирует подклапанное сужение лёгочного ствола, которое проявляется в момент сокращения желудочка (т. е. в систолу). Градиент давления между входным и выходным отделами желудочка может возрасти настолько, что давление в правом желудочке вначале становится равным давлению в левом, а потом начинает его превышать.
Спонтанное закрытие дефекта перегородки благодаря разрастанию фиброзной ткани и рубцеванию, а также прирастание створок трёхстворчатого клапана или клапанов аорты к краям дефекта происходит у 25—50% больных, преимущественно в раннем детском возрасте.
Дефект межжелудочковой перегородки может сочетаться с артериальным протоком, дефектом межпредсердной перегородки, коарктацией аорты, врождённым митральным стенозом или митральной недостаточностью, аномальной левой верхней полой веной, впадающей в коронарный синус.
Направление и величина шунта на уровне желудочков исключительно зависят от соотношения давления между желудочками в систолу и диастолу. При небольшом и среднего размера дефекте движущей силой шунта является градиент давления между левым и правым желудочками. В этом случае объем сбрасываемой крови будет определяться величиной сопротивления, создаваемого патологический отверстием. Максимальная разница в давлении падает на середину и вторую половину систолы. В эту фазу сокращения возникает наиболее интенсивный кровоток через дефект, что определяет на ФКГ характерную форму систолического шума (с усилением ко II тону). При большом дефекте сопротивление не создаётся. Градиент между желудочками, как правило, невелик. Величина шунта в этом случае зависит только от соотношения сосудистого сопротивления в большом и малом круге кровообращения. Преимущественный кровоток будет в сторону меньшего сопротивления. Кроме того, в систоле происходит сокращение перегородки и соответственно меняются размеры и форма дефекта, его соотношение с внутриполостными структурами (клапанами) и наджелудочковым гребнем, что также влияет на величину шунта. В диастоле и в самом начале систолы направление и величина сброса крови определяются относительной податливостью (эластичностью) желудочковых отделов, диастолическим давлением, асинхронностью сокращений.
Артериовенозное шунтирование приводит к возрастанию лёгочного кровотока. Через левое атриовентрикулярное отверстие протекает увеличенное количество крови. В результате возникает перегрузка обоих желудочков и левого предсердия, которая соответствует величине шунта (слева направо). При развитии лёгочной гипертензии объем шунта уменьшается, а позднее, когда давление в правом желудочке начинает превышать давление в левом желудочке, становится преимущественно венозно-артериальным. На этой стадии дилатация левых отделов сердца несколько уменьшается, а правый желудочек резко гипертрофируется.
Артериовенозный шунт при дефекте межжелудочковой перегородки оказывает существенное влияние на сосуды малого круга кровообращения. При малом дефекте давление в правом желудочке не повышено, несколько увеличен лёгочный кровоток: на этой стадии легочно-сосудистое сопротивление нормальное. При большом дефекте перегородки оно может быть увеличено, что приводит к развитию лёгочной гипертензии. Объем шунта и соответственно лёгочный кровоток обратно пропорциональны соотношению величин сопротивления в малом и большом кругах кровообращения. Так, например, при отношении менее 0,4 артериовенозный сброс крови может быть большим, а лёгочный кровоток резко увеличенным, что приводит к лёгочной гипертензии гиперволемического характера; если отношение колеблется между 0,4 и 0,7, лёгочный кровоток умеренно увеличен, а лёгочная гипертензия будет смешанного характера — гиперволемическая (т. е. сохранен сброс крови) и гиперкинетическая (т. к. повышено легочно-сосудистое сопротивление). Отношение более 0,7 соответствует уравновешенному или обратному сбросу крови, высокому лёгочному артериальному давлению и уменьшенному лёгочному кровотоку; лёгочная гипертензия гиперкинетическая.
Если у здоровых людей физическая нагрузка, сопровождающаяся заметным повышением производительности сердца, приводит к падению легочно-сосудистого сопротивления, то при наличии фиксированного высокого лёгочного сопротивления повышение нагрузки может привести к острой сердечной недостаточности. У больных с дефектом межжелудочковой перегородки и высокой лёгочной гипертензией увеличение минутного объёма сердца означает увеличение венозно-артериального сброса, усиление цианоза и ещё большую потребность в артериальной крови.
У большинства больных при небольшом дефекте межжелудочковой перегородки и незначительном артериовенозном шунте клинические, проявлений порока практически не отмечается. При больших дефектах перегородки (в 20% случаев) наблюдается выраженная клинические, картина. У новорождённых при большом дефекте перегородки и высоком легочно-сосудистом сопротивлении быстро возникает острая сердечная недостаточность, которая может стать хронической; наблюдается физическое недоразвитие. У новорождённых с эмбриональным типом сосудов, высоким сосудистым сопротивлением, гиперкинетической лёгочной гипертензией, являющихся необратимыми, превышением давления в правом желудочке по сравнению с левым наступает венозно-артериальный сброс крови, приводящий к появлению цианоза и эритроцитоза (смотри полный свод знаний). Такое сочетание гемодинамических и клинические, изменений, развивающихся при дефекте межжелудочковой перегородки, носит название комплекса Эйзенменгера. Новорожденные с большим дефектом перегородки, незначительно увеличенным легочно-сосудистым сопротивлением и лёгочной гипертензией гиперволемического характера также отстают в физическом развитии и плохо переносят физические нагрузки. Если на протяжении первых лет жизни не происходит спонтанного закрытия дефекта или его уменьшения, то к 20 годам лёгочная гипертензия становится гиперкинетической и необратимой, развивается комплекс Эйзенменгера. Появляются вначале при нагрузках, позднее постоянно цианоз, эритроцитоз, венозно-артериальный шунт.
В некоторых случаях легочно-сосудистое сопротивление не повышается и наблюдается хронический сердечная недостаточность. У части больных развивается бактериальный эндокардит (смотри полный свод знаний).
Таким образом, клинические, картина порока имеет прямую зависимость от размеров дефекта перегородки, величины лёгочного кровотока и степени лёгочной гипертензии. При небольшом дефекте перегородки над сердцем в третьем-четвёртом межреберье по левому краю грудины наблюдается дрожание и выслушивается интенсивный систолический шум, хотя со стороны больного жалобы отсутствуют.
Дети со средним и большим дефектом перегородки часто жалуются на одышку при умеренных физических нагрузках и повышенную утомляемость. При физикальном обследовании выявляется увеличенное сердце, отчётливое дрожание и выраженный пансистолический шум с максимумом в четвёртом межреберье по левому краю грудины. Верхушечный толчок усилен. Над верхушкой сердца — лёгкий протодиастолический шум. II тон расщеплен (при отсутствии лёгочной гипертензии), его лёгочный компонент может быть усилен. У больных с аортальной недостаточностью (вследствие пролабирования створки клапанов аорты) прослушивается протодиастолический шум над аортой в третьем-четвёртом межреберье слева от грудины. Нередко имеются признаки сердечной недостаточности (тахикардия, одышка, гепатомегалия, отеки), которую усиливают сопутствующие Пороки сердца врождённые Присоединяются нарушения сердечного ритма. При декомпенсации несколько ослабевают систолический шум и II тон. Для больных с крайней степенью лёгочной гипертензии характерен слабый систолический шум и резко усиленный монофазный тон.
На ЭКГ отмечаются признаки левожелудочковой гипертрофии. При большом артериовенозном шунте и развитии лёгочной гипертензии оба желудочка гипертрофированы. С нарастанием лёгочной гипертензии увеличиваются зубцы R в правых прекардиальных отведениях. При комплексе Эйзенменгера — картина выраженной систолической перегрузки правого желудочка.
При рентгенологическое исследовании у больных со средними и большими дефектами перегородки находят увеличение обоих желудочков, усиление лёгочного рисунка в прикорневых отделах лёгких и расширение тени лёгочных сосудов (рисунок 10). С развитием лёгочной гипертензии размеры сердца несколько сокращаются, начинает выбухать дуга лёгочного ствола, ослабляется периферический лёгочный рисунок, резко гипертрофирован и увеличен правый желудочек.
При катетеризации сердца катетер нередко удаётся провести из правого желудочка через дефект межжелудочковой перегородки в аорту. Измерение давления в правых отделах сердца и лёгочном стволе позволяет оценить степень и обратимость нарушений гемодинамики. Сброс крови через межжелудочковый дефект устанавливают либо исследованием крови на насыщение кислородом, либо красочными, термодилюционными, платиноводородными пробами. Дефект перегородки обнаруживается при контрастировании левого желудочка. Для этого катетер проводят ретроградно по Сельдингеру в корень аорты. Подтягивают проволочный проводник на несколько сантиметров, благодаря чему конец зонда становится менее упругим и его изгибают. После этого катетер благодаря наличию кривизны располагается по центру аорты и сравнительно легко проводится в полость левого желудочка. Этот момент может сопровождаться появлением групповых экстрасистол. Рентгеноконтрастное исследование предпочтительно выполнить в левой косой или боковой проекциях. Через катетер в полость левого желудочка с помощью автоматического шприца под давлением 1 ½—2 атмосфер в течение нескольких секунд вводят максимально возможное количество контрастного вещества. Это приводит к «тугому» заполнению контрастной массой полости левого желудочка, что даёт возможность оценить динамику сокращения левого желудочка и его опорожнение. При этом становится хорошо видимой аорта с коронарными сосудами и патологический сообщение с правым желудочком. Если удаётся достичь в момент съёмки сагитального расположения межжелудочковой перегородки в области дефекта, то диаметр сбрасываемой струи контрастного вещества в правый желудочек будет соответствовать диаметру дефекта. Чаще всего шунтирование происходит на уровне выходного отдела левого и правого желудочка и контрастная масса практически сразу после попадания в правый желудочек оказывается в лёгочном стволе. Таким образом контрастирование левого желудочка позволяет соотнести размеры аорты и лёгочного ствола. По плотности их контрастирования можно судить и о величине артериовенозного шунтирования. Информативность скоростной рентгеновской съёмки (киноангиокардиографии) значительно выше обычной (крупноформатной) съёмки. Она позволяет более детально оценить морфологию порока, динамику сброса крови в различные моменты фазы сердечного сокращения и другие особенности морфологии и гемодинамики (например, множественность дефектов или необычность их локализации, двухсторонний характер сброса контрастного вещества при больших дефектах и развитии лёгочной гипертензии, преобладание венозно-артериального шунтирования).
Дифференциальную диагностику проводят с пороками, сопровождающимися артериовенозным сбросом крови (артериальным протоком, аортолёгочным свищом, прорывом аневризмы синуса Вальсальвы и другие). Катетеризация и контрастирование сердца позволяют установить окончательный диагноз.
Показания к оперативному лечению возникают при величине артериовенозного шунтирования, превышающей 30—35% минутного объёма малого круга кровообращения. Если больной страдает бактериальным эндокардитом, который протекает хронически, с тенденцией к частым обострениям, несмотря на активную медикаментозную терапию, показания к операции могут быть расширены. У новорождённых и детей в возрасте до 3 лет в связи с острой сердечной недостаточностью могут возникнуть показания к неотложной коррекции порока. В некоторых случаях при формирующейся лёгочной гипертензии и тяжёлом общем состоянии ребёнка оправдано оперативное вмешательство с целью сужения лёгочного ствола. При сопутствующих других Пороки сердца врождённые коррекция пороков может быть расчленена на два этапа: вначале устраняют открытый артериальный проток, коарктацию аорты и другие, а затем дефект межжелудочковой перегородки.
Закрытие дефекта межжелудочковой перегородки осуществляют в условиях искусственного кровообращения. Доступ — срединная стернотомия или правосторонняя торакотомия с пересечением грудины. Подход к межжелудочковой перегородке зависит от локализации дефекта: надгребневые и мышечные (возле верхушки сердца) удобнее оперировать через стенку правого желудочка (поперечная, косая вентрикулотомия), подгребневые, задние подстворочные, а также мышечные вблизи от фиброзного кольца трёхстворчатого клапана — через стенку правого предсердия (атриотомия). Если дефект межжелудочковой перегородки сочетается с аортальной недостаточностью, то подход может быть чрезаортальным. В этом случае при невозможности сохранить клапаны аорты (вследствие их большой деформации) одну из створок клапанов надсекают по комиссурам и подшивают к краям дефекта. Аортальный клапан протезируют. Однако в некоторых случаях закрытие дефекта заплатой (со стороны правого желудочка) создаёт опору клапану аорты, в результате исчезает или уменьшается регургитация из аорты (то есть протезирования клапанов не требуется). Уже во время операции (после герметичного закрытия дефекта) систолический шум полностью исчезает (рисунок 11).
Небольшие дефекты межжелудочковой перегородки ушивают, причём наиболее надёжными являются П-образные швы с прокладками. Почти в 80% случаев средних и больших дефектов необходимо пластическое закрытие отверстия заплатами из аутоперикарда или полимерных материалов (смотри полный свод знаний). Более предпочтительно подшивание заплаты матрацным швом со стороны левого желудочка. Для этого после наложения швов на заплату и края дефекта, заплату опускают через отверстие в левый желудочек, швы подтягивают и связывают между собой. Рассекать створку трёхстворчатого клапана не требуется. Профилактика повреждения проводящих путей заключается в наложении швов на некотором расстоянии от края дефекта, где проходит пучок и ножки пучка Гиса. Множественные мышечные дефекты закрывают после правожелудочковой или левожелудочковой вентрикулотомии общей заплатой из аутоперикарда или подшиванием участка стенки желудочка к краям дефекта. При сочетании подклапанного стеноза лёгочного ствола с дефектом перепончатого отдела межжелудочковой перегородки возможно закрытие отверстия мышечным лоскутом, выкроенным из наджелудочкового гребня.
 |
|  |
Рис. 11. | ||
Дети первого года жизни с хронический сердечной недостаточностью, развившейся вследствие нарушений гемодинамики, часто погибают. Больные с комплексом Эйзенменгера обычно погибают до 30 лет из-за осложнений, связанных с эритроцитозом и гипоксией (смотри полный свод знаний). После операций исход зависит от степени исходных нарушений гемодинамики и их обратимости.
При двухэтапном лечении (вначале сужение лёгочного ствола, спустя несколько лет — закрытие дефекта перегородки и расширение лёгочного ствола) погибает 6—8% больных. При одномоментном устранении порока у идентичной категории больных летальность такая же. Больные с выраженной лёгочной гипертензией (отношение лёгочно-сосудистого сопротивления к системному более 0,75) после операции погибают чаще (в 15—30% случаев). В отдалённые сроки после операции погибает ещё 25%. Лёгочная гипертензия сохраняется у 25% больных, то есть только 25% оперированных выздоравливают. Летальность у больных с множественными дефектами мышечного отдела перегородки выше, чем у больных с другой локализацией порока, у них также выше число реканализаций. Резидуальный шунт отмечается у 10—14% оперированных, однако его величина столь незначительна, что повторного вмешательства не требуется.
У больных с умеренной лёгочной гипертензией, имевшейся до операции, в 70% случаев после операции давление в лёгочном стволе и легочно-сосудистое сопротивление нормализуются.
Полная атриовентрикулярная блокада возникает редко. Св. 95% больных без лёгочной гипертензии выздоравливает — у них уменьшаются размеры сердца, исчезает одышка, дети быстро набирают вес и растут. Успешная коррекция порока снижает вероятность заболевания бактериальным эндокардитом.
Больные с нормальными показателями гемодинамики, не имеющие шумов в сердце, несмотря на изменения ЭКГ и размеров сердца, как правило, хорошо переносят физические нагрузки и могут вести обычный образ жизни.
Дефект межпредсердной перегородки (рисунок 1, е) встречается в возрасте до 14 лет (1 : 13 500). В среднем он составляет 7% всех Пороки сердца врождённые; у девочек бывает в 3 раза чаще, чем у мальчиков.
Нарушения в формировании перегородки приводят к появлению той или иной формы порока: сохранению первичного дефекта, образованию овального окна, вторичного дефекта, атриовентрикулярного канала (частичного или полного) при сохранении межжелудочкового дефекта, дефекта венозного синуса, если отверстие расположено вблизи полой вены и сочетается с аномальным впадением в неё лёгочных вен.
Первичный дефект межпредсердной перегородки наблюдается в 10%, атриовентрикулярный канал — в 20% и вторичный дефект — в 70% случаев. Первичный дефект отмечен в равном числе у мальчиков и девочек; атриовентрикулярный канал — более частая патология у новорождённых. Патологический отверстие между предсердиями бывает различных размеров — от нескольких миллиметров до 5 см. Нередко наблюдается несколько отверстий. Вторичный дефект располагается под устьем верхней полой вены (высокий), в центре перегородки, над нижней полой веной (низкий). Примерно у 10% больных с Пороки сердца врождённые выявляется аномальное впадение правых лёгочных вен; реже обнаруживают аномальное впадение верхней полой вены. Полное отсутствие перегородки обозначают как трёхкамерное сердце (то есть единое предсердие и два желудочка).
При вторичных дефектах перегородки наиболее частая локализация порока — овальное окно, как правило, в центре её. Отверстие может быть также смещено медиально (внутренний край образует аорта), латерально (наружный край — стенка предсердия). Отверстие, расположенное возле верхней или нижней полой вены, обозначают соответственно как верхний или нижний вторичный дефект перегородки. Размеры дефекта бывают различными — от нескольких миллиметров до нескольких сантиметров и даже до полного отсутствия перегородки между полыми венами и аортой. Иногда наблюдаются множественные дефекты, или сетчатая перегородка.
Через патологический отверстие возникает сброс крови из левого предсердия в правое (градиент давления между ними равен 3—4 миллиметров ртутного столба). Максимальный сброс крови происходит в самом начале систолы, в конце систолы и начале диастолы. Градиент давления выравнивается при большом отверстии, превращающем оба предсердия в одну полость. В этом случае сброс крови и гиперволемия зависят от соотношения величин диастолического давления в желудочках. Неравномерное перемешивание крови в едином предсердии может сопровождаться, несмотря на гиперволемию малого круга кровообращения, цианозом. Циркуляция дополнительного объёма крови через малый круг приводит к дилатации правого желудочка, расширению лёгочного ствола и её ветвей. Лёгочная гипертензия (смотри полный свод знаний: Гипертензия малого круга кровообращения) развивается сравнительно поздно, обычно после 30 лет. Она приводит к гипертрофии правого желудочка и ещё большей дилатации лёгочного ствола. Увеличение конечно-диастолического давления в правом желудочке затрудняет его заполнение. Повышается давление в правом предсердии, в связи с этим появляются признаки сердечной декомпенсации. Уменьшается градиент давления между предсердиями, сброс крови на некоторое время уравновешивается, а позднее изменяет направление на обратное, то есть из правого предсердия в левое.
Объем шунта (т. е. сброс крови через дефект межпредсердной перегородки) может достигать огромных размеров, в результате чего лёгочный кровоток будет превышать объем кровотока в большом круге кровообращения в 3—4 раза. Кровоток в большом круге нормальный или слегка уменьшен, что приводит к физическому отставанию в развитии больных, При большом шунте градиент давления между правым желудочком и лёгочным стволом достигает 40 миллиметров ртутного столба.
Описанные патофизиологические нарушения характерны для любой формы дефекта межпредсердной перегородки и отражают в основном последствия артериовенозного сброса крови.
Неосложнённый дефект межпредсердной перегородки редко беспокоит больных. Появление одышки и повышенной утомляемости при обычных физических нагрузках — признаки скрытой сердечной недостаточности. У детей она развивается при первичном дефекте перегородки; при вторичном — после 30 лет (40% случаев). Лёгочная гипертензия нарастает медленно и проявляется только у взрослых (5—10%). Нередко у взрослых наблюдаются стойкие нарушения сердечного ритма — экстрасистолия, пароксизмальная тахикардия, мерцательная аритмия и другие (смотри полный свод знаний: Аритмия сердца).
Характерными проявлениями порока являются мезосистолический шум (смотри полный свод знаний: Сердечные шумы) и расщепление II тона над лёгочным стволом. Систолический шум над лёгочным стволом, связанный с турбулентным кровотоком, отражает резко увеличенный ударный объем правых отделов сердца. На вдохе и выдохе величина расщепления II тона практически не меняется. При большом артериовенозном шунте (более 2:1) над мечевидным отростком определяется протодиастолический шум вследствие функционального сужения трёхстворчатого клапана.
Характерные признаки на ЭКГ: отклонение электрической оси сердца вправо (при вторичных дефектах) и влево (при первичных дефектах); неполная блокада правой ножки предсердно-желудочкового пучка, или пучка Гиса (смотри полный свод знаний: Блокада сердца); признаки гипертрофии правого желудочка.
Рентгенологические исследование выявляет увеличение правых отделов сердца и усиление кровенаполнения лёгочных сосудов. Гипертрофия правого желудочка обнаруживается главным образом в правой косой или левой боковой проекциях. Лёгочный ствол дилатирован и при высокой гипертензии (рисунок 12) может быть аневризматически расширен.
При катетеризации сердца катетер обычно легко проходит через межпредсердный дефект. Повышение насыщения крови кислородом в пробах из правого предсердия, положительная платино-водородная проба указывают на артериовенозное шунтирование на этом уровне. Для уточнения локализации шунта платино-водородную пробу повторяют при положении датчика в различных отделах предсердия и полых вен.
При контрастировании левого предсердия обнаруживают отверстие, через которое контрастное вещество поступает в правые отделы сердца.
Дифференциальную диагностику проводят между различными формами дефекта межпредсердной перегородки, аномалиями венозного притока к сердцу, умеренным стенозом лёгочного ствола, дефектом межжелудочковой перегородки, в особенности с сочетанной недостаточностью трёхстворчатого клапана, а также врождённой недостаточностью митрального клапана.
Лечение оперативное. Закрытие вторичного дефекта перегородки производят на «открытом» сердце в условиях гипотермии или искусственного кровообращения ушиванием или наложением заплаты.
После операции по поводу вторичного дефекта перегородки летальность 1%, первичного — до 3%.
В послеоперационном периоде могут возникать осложнения: нарушения сердечного ритма (мерцательная аритмия и другие), кровотечение и другие В отдалённые сроки после операции 80—90% пациентов практически здоровы.
Коарктация аорты (стеноз или полная атрезия аорты). Выделяют изолированную коарктацию, коарктацию в сочетании с артериальным протоком или другими Пороки сердца врождённые Клинические, картина в разном возрасте (у детей, подростков, взрослых) не одинакова. Лечение оперативное (смотри полный свод знаний: Коарктация аорты).
Коронарно-сердечные свищи (аневризмы коронарных артерий) представляют собой одиночные или множественные патологический сообщения коронарной артерии с одной из полостей сердца, приводящие к аневризматическому расширению сосуда и сбросу крови из аорты в сердце. Порок сравнительно редкий. Свищи правой (60%) или левой (40%) коронарной артерии могут сообщаться с полостью сердца, коронарным синусом и являются причиной артериовенозного шунтирования и увеличения лёгочного кровотока (рисунок 1, ж).
Ускоренный и усиленный кровоток приводит к уменьшению объёма артериальной крови, поступающей в миокард. Стенка коронарной артерии резко изменяется за счёт потери эластических элементов и фиброзного перерождения; неравномерные утолщения чередуются с истончением стенки, в связи с чем возникает опасность разрыва сосуда.
Ишемия миокарда, связанная со сбрасыванием крови, проявляется типичными загрудинными болями, усиливающимися при нагрузке, одышкой, повышенной утомляемостью. При большом сбросе крови может возникнуть сердечная недостаточность. При физикальном обследовании обнаруживают интенсивный «машинный» непрерывный систолодиастолический шум, в некоторых случаях только систолический шум небольшой интенсивности. ЭКГ чаще не изменена или с признаками небольшой перегрузки левого желудочка.
При рентгенологическое исследовании больных с большим артериовенозным сбросом обнаруживают расширение аорты, увеличение левого желудочка и усиление лёгочного рисунка с умеренной дилатацией лёгочного ствола. Селективная коронарография (смотри полный свод знаний) или аортография (смотри полный свод знаний) позволяют видеть изменённую коронарную артерию, свищ и сброс крови в один из отделов сердца (рисунок 13).
Во всех случаях порока показано оперативное лечение. На работающем сердце выделяют аневризматически изменённый сосуд, лигируют свищи снаружи или на «открытом» сердце, вскрыв соответствующую его полость, ушивают их изнутри, контролируя по ЭКГ кровоснабжение миокарда в соседних зонах.
Послеоперационная летальность не превышает 1 %. Результаты в отдалённые сроки после операции хорошие.
Корригированная транспозиция аорты и лёгочного ствола (синонимы: инверсионная транспозиция сосудов, зеркальное расположение желудочков, псевдотранспозиция, ацианотическая транспозиция, смешанная левокардия с транспозицией желудочков и полной псевдотранспозицией аорты и лёгочного ствола) — порок, при котором имеется транспозиция крупных сосудов при нормальном токе крови: артериальной — в аорту, венозной — в лёгочный ствол. Порок практически всегда сочетается с другими Пороки сердца врождённые (дефектом перегородок, недостаточностью клапанов и другие). Встречается в 0,6% случаев Пороки сердца врождённые
В основе транспозиции лежат нарушения механизма формирования (инверсии) бульбарного отдела сердца: оба сосуда не пересекаются, а лежат параллельно, причём устье аорты кпереди от устья лёгочного ствола. Несмотря на это, аорта начинается от артериального левого желудочка, а лёгочный ствол от венозного правого желудочка. Порок может представлять собой изолированную инверсию луковицы аорты либо сочетание инверсии луковицы аорты с зеркальным расположением желудочков или предсердий, хотя в этом случае имеется аномалия расположения сердца. При инверсии луковицы аорты лёгочный ствол отходит от правого желудочка, начинаясь кзади от аорты, и идёт параллельно с ней, предлежа справа.
Бульбарно-вентрикулярная инверсия дополнительно характеризуется зеркальной локализацией желудочков. Лёгочный ствол лежит справа от аорты, начинается от левого желудочка, который находится справа, и через митральный клапан получает венозную кровь из обычно расположенного правого предсердия. Аорта начинается от правого желудочка, расположенного слева от межжелудочковой перегородки; через трёхстворчатый клапан в него поступает артериальная кровь из левого предсердия. При этом клапан аорты отделен от левого митрального клапана наджелудочковым гребнем, а перегородочная створка трёхстворчатого клапана непосредственно продолжается в клапан лёгочного ствола.
Существуют различные сочетания корригированной транспозиции, расположения и формирования сердца.
Клиническая картина полностью зависит от выраженности сопутствующих пороков сердца и соответствует тем или иным нарушениям гемодинамики. Для корригированной транспозиции сосудов характерна полная поперечная блокада сердца, которая вначале имеет перемежающийся характер.
На ЭКГ обнаруживается отклонение электрической оси сердца влево при наличии признаков лёгочной гипертензии и аномально расположенного сердца. При рентгенологическое исследовании по левому контуру сердца видны только две дуги (из четырёх): верхняя (восходящая часть аорты) — большая, простирающаяся высоко вверх, и дуга, образованная контуром необычно расположенного сердца.
При катетеризации сердца невозможно проведение катетера из правого желудочка в лёгочный ствол. Одновременно выявляются сопутствующие пороки (дефекты перегородок, открытый артериальный проток). Контрастирование правых отделов чётко выявляет инверсию бульбарной или вентрикулярнобульбарной части сердца. В прямой проекции лёгочный ствол смещён вправо, а в боковой — кзади от аорты. При заполнении контрастным веществом левого предсердия видно, что оно располагается позади артериального конуса правого желудочка. Форма обоих желудочков также необычна.
Нарушения гемодинамики являются следствием сопутствующих пороков сердца. Часто возникают расстройства атриовентрикулярной проводимости. Почти у половины больных имеется полная поперечная блокада сердца (смотри полный свод знаний: Блокада сердца).
Дифференциальную диагностику проводят с врождённой полной поперечной блокадой сердца, трикуспидальной атрезией, полной транспозицией сосудов, атриовентрикулярным каналом и другие
Лечение направлено на устранение сопутствующих пороков. Полная поперечная блокада может потребовать имплантации кардиостимулятора (смотри полный свод знаний: Кардиостимуляция). Закрытие дефекта межжелудочковой перегородки, как правило, затруднено из-за необычного доступа. Риск операции увеличивается также из-за возможных последующих нарушений функции предсердно-желудочковых клапанов, больших размеров дефекта, вероятности аномального отхождения коронарных артерий. Острая недостаточность трёхстворчатого клапана (выполняющего роль митрального) может вызвать необходимость протезирования клапана. Операция нередко осложняется развитием поперечной блокады сердца. Для уменьшения риска целесообразно в ходе внутрисердечных манипуляций выявить локализацию элементов проводящей системы сердца.
Исходы зависят от степени радикальности оперативного вмешательства и возможности последующего развития полной поперечной блокады сердца.
Левожелудочково-правопредсердный свищ (шунт) располагается вблизи фиброзного кольца трёхстворчатого клапана, может сочетаться с недостаточностью трёхстворчатого клапана (в виде расщепления, перфорации створки). При таком сочетании происходит сброс крови из левого желудочка в правое предсердие. Порок сравнительно редкий. Одна из особенностей анатомии межжелудочковой перегородки в её перепончатой части состоит в том, что небольшая её часть находится выше основания створки трёхстворчатого клапана. Это место соответствует границе между перегородочной и передней створками клапана. При образовании свища возникает прямое сообщение между левым желудочком и правым предсердием. Как правило, отверстие небольшого размера. Иногда (при средних по величине отверстиях) гемодинамические нарушения могут быть значительными из-за большого градиента давления между левым желудочком и правым предсердием (это сопровождается выраженным сбросом крови слева направо). Они аналогичны тем, которые наблюдаются при дефекте межжелудочковой перегородки, однако недостаточность трёхстворчатого клапана проявляется высоким венозным давлением, увеличением печени, набуханием и пульсацией вен шеи. Признаки сердечной недостаточности могут проявиться в раннем детском возрасте пли позже.
Больные с этим пороком физически недоразвиты. Основные жалобы — одышка, повышенная утомляемость. При физикальном обследовании можно обнаружить увеличение правых границ сердца, резкий пансистолический шум справа, над грудиной и в эпигастрии. Данные ЭКГ аналогичны изменениям при дефекте межжелудочковой перегородки. Рентгенологические исследование выявляет увеличение правого предсердия, желудочков и усиление лёгочного рисунка. При развитии лёгочной гипертензии выбухает лёгочный ствол, периферический лёгочный рисунок обеднён.
Во время катетеризации сердца обнаруживают повышение оксигенации крови на уровне правого предсердия. Давление в правых отделах сердца и лёгочном стволе повышено. При контрастировании левого желудочка через ретроградно проведённый зонд контрастное вещество появляется в правом предсердии, что лучше видно в левой косой проекции.
Лечение только оперативное. В условиях искусственного кровообращения через правое предсердие свищ ушивают либо закрывают заплатой; производят также анулопликацию или сшивание створки. Летальность после операции не более 5%. Результаты хорошие и в отдалённые сроки.
Митральная атрезия сочетается с нормальным клапаном аорты, а гипоплазированный левый желудочек через дефект межжелудочковой перегородки сообщается с большим правым желудочком. Возможно сочетание митральной атрезии с частичным аномальным впадением лёгочных вен в правое предсердие. Новорожденные с митральной атрезией вскоре погибают.
Митральный стеноз. Приблизительно у половины больных с врождённым митральным стенозом гипоплазированы левые отделы сердца, имеется аортальная атрезия. При этом створки митрального клапана практически не дифференцируются, утолщены и образуют как бы воронку. Сухожильные хорды укорачиваются и срастаются между собой. Сравнительно часто находят открытый артериальный проток, аортальный стеноз, коарктацию аорты. Застойные явления в лёгких, лёгочная гипертензия служат одной из причин одышки и частых респираторных заболеваний. Над верхушкой сердца выслушивается грубый диастолический шум, щелчок открытия митрального клапана, пресистолический шум, резко усиленный I тон. На рентгенограммах видны расширенное левое предсердие и усиленный прикорневой лёгочный рисунок. Если стеноз не устраняют, развивается лёгочная гипертензия.
Около половины детей с этим пороком погибает на первом году жизни. В некоторых случаях может быть выполнена пластика митрального клапана. Однако из-за резкой деформации клапана чаще приходится его иссекать и вшивать клапанный протез.
Недостаточность клапана лёгочного ствола встречается не более чем в 0,2% случаев Пороки сердца врождённые
В период диастолы часть объёма ударного выброса из правого желудочка возвращается в его полость, вследствие чего правый желудочек дилатируется и гипертрофируется. Давление в лёгочном стволе в период систолы возрастает, в период диастолы снижается почти до 0. Однако описываемые нарушения при изолированном пороке встречаются тем реже, чем ниже давление в правом желудочке. Гипертрофия и дилатация этого отдела сердца заметно развиваются лишь при условиях, ведущих к гипертензии правых отделов сердца (беременность, хронический лёгочные заболевания, большие физические нагрузки и тому подобное).
В области фиброзного кольца клапана лёгочного ствола имеется валик плотной фиброзной ткани, напоминающий со стороны дилатированного лёгочного ствола рыбий рот. Полость правого желудочка также расширена, стенка желудочка гипертрофирована.
Больные обычно чувствуют себя удовлетворительно. При аускультации слева от грудины во втором третьем межреберье выслушиваются короткий систолический и выраженный протодиастолический шумы («шум пильщика»).
На ЭКГ могут быть признаки диастолической перегрузки правого желудочка, смещение электрической оси сердца вправо. Рентгенологические исследование позволяет установить увеличение правого желудочка, дилатацию лёгочного ствола, его усиленную пульсацию и пульсацию корней лёгких.
Катетеризация сердца и контрастное исследование уточняют степень нарушений гемодинамики и величину регургитации из лёгочного ствола.
Изолированная недостаточность клапана лёгочного ствола лечения обычно не требует, в отдельных случаях показано протезирование клапана.
Недостаточность митрального клапана — редкий Пороки сердца врождённые, вызван деформацией митральных створок, укорочением и утолщением сухожильных хорд, дилактацией митрального кольца или расщеплением створок. Обычно сочетается с другими пороками, например, атриовентрикулярным каналом, коарктацией аорты, корригированной транспозицией крупных сосудов.
Степень недостаточности клапана широко варьирует. Выраженная степень сопровождается сердечной недостаточностью со всеми проявлениями (отеки, гепатомегалия, одышка, нарушения сердечного ритма). Дети с этим пороком отстают в физическом развитии. Пансистолический шум выявляется максимально над верхушкой сердца и проводится в левую подмышечную область.
ЭКГ выявляет признаки гипертрофии левого желудочка. Рентгенологически обнаруживается кардиомегалия с дилатацией левого предсердия (до аневризматического расширения) и легочно-венозным застоем.
Степень митральной недостаточности определяется во время катетеризации сердца и контрастирования левого желудочка (при ретроградном проведении катетера).
Детей с признаками сердечной недостаточности необходимо оперировать. Операция не рекомендуется при умеренных проявлениях порока. При наличии сопутствующих пороков в первую очередь показано их устранение. Вальвулопластика (смотри полный свод знаний) или анулопластика предпочтительнее, чем протезирование клапана (смотри полный свод знаний: Протезирование клапанов сердца). Однако почти половина больных все же нуждается в замене клапана.
Послеоперационная летальность около 10%. В дальнейшем дети нуждаются в повторных операциях для замены клапана на клапан большего размера.
Общий артериальный ствол — единый сосуд с 3—6 полулунными створками расположен над межжелудочковой перегородкой и принимает всю кровь, выбрасываемую сердцем. Большой дефект межжелудочковой перегородки локализуется под единым клапаном, нередко имеющим недостаточность. Среди Пороки сердца врождённые встречается не чаще чем в 1 % случаев.
Порок развивается на 6-й неделе эмбрионального развития вследствие нарушения механизма образования перегородки артериального ствола. Так как эта перегородка принимает участие в формировании перепончатой части межжелудочковой перегородки, одновременно образуется и дефект межжелудочковой перегородки, иногда достигающий огромных размеров. Если обе половины шестой пары дуги аорты не утрачивают сообщения с эмбриональным артериальным стволом, то лёгочный ствол отходит от восходящей части аорты. Если же сообщение лёгочных сосудов с эмбриональным артериальным стволом прекращается, кровообращение в течение некоторого времени возможно лишь через артериальный проток. После его закрытия в первые два месяца жизни дети погибают. Дети выживают в случаях развития коллатералей из сосудов средостения или бронхиальных артерий, так как кровь начинает поступать в лёгкие.
Общий артериальный ствол — как правило, расширенный сосуд, «сидящий верхом» на межжелудочковой перегородке. Большой дефект перегородки, по существу, превращает оба желудочка в единую полость. Имеются два типа порока. При I типе лёгочный ствол отходит от восходящей части аорты и делится на правую и левую лёгочные артерии. Часто обе ветви имеют самостоятельные устья. Иногда наблюдаются несколько сосудов, отходящих от общего артериального ствола к долям лёгких.
При II типе лёгочные сосуды множественными стволами отходят от нисходящей части грудной аорты.
У большинства больных отмечается лёгочная гиперволемия, которая может вызвать сердечную недостаточность. Постепенно формируется лёгочная гипертензия с необратимыми склеротическими изменениями артериальных сосудов. Значительно реже лёгочный кровоток редуцирован или наблюдается баланс кровотока в обоих кругах кровообращения.
Клиническая картина обусловлена особенностями гемодинамики. У больных с увеличенным кровотоком в лёгких отмечается бледность, отставание в физическом развитии, одышка, повышенная утомляемость. При развитии лёгочной гипертензии порок протекает с клинические, признаками комплекса Эйзенменгера. Выраженная гиперволемия может сопровождаться периодически возникающими явлениями острой сердечной недостаточности. У больных со сбалансированным кровотоком симптоматика менее выражена. При редуцированном лёгочном кровотоке (II тип порока) наблюдается выраженный цианоз, клинические, картина напоминает тетраду Фалло. У больных с общим артериальным стволом сердце увеличено, выслушивается монофазный II тон, легкий систолический шум в третьем межреберье у левого края грудины, иногда непрерывный шум в межлопаточном промежутке (вследствие кровотока по коллатеральным сосудам).
На ЭКГ характерные признаки порока не выявляются; при выраженной гиперволемии обнаруживается перегрузка левого желудочка. При рентгенологическое исследовании отмечается аортальная конфигурация сердца, тень его расширена, аорта дилатирована и выступает вправо и вниз (рисунок 14). В области лёгочного ствола имеет место западение тени (подчёркнутая «талия»). При лёгочной гиперволемии сосудистый рисунок лёгких усилен, при гиповолемии ослаблен. Корни лёгких могут проецироваться необычно высоко.
При катетеризации сердца катетер из правого желудочка проходит только в аорту. В правом желудочке и аорте находят прибавление оксигенированной крови. Наиболее ценным исследованием является аортография — обнаруживается расширение аорты в 2—3 раза по отношению к нормальным размерам и отхождение от неё лёгочных сосудов.
Паллиативные операции — сужение лёгочных сосудов малого круга (при гиперволемии) или нисходящей части аорты (при гиповолемии) — являются первым этапом лечения в раннем детском возрасте; радикальное вмешательство производят в условиях искусственного кровообращения. Лёгочные сосуды отделяют об общего артериального ствола, закрывают заплатой дефект межжелудочковой перегородки и вшивают кондуит между правым желудочком и отсеченными. Лёгочными артериями.
Без оперативного вмешательства почти все дети погибают. Летальность после паллиативных операций у новорождённых тоже высокая, после радикальных операций, если нет лёгочной гипертензии, около 10%, если есть — до 80%.
Состояние больных в отдалённые сроки после операции относительно удовлетворительное, симптомы порока исчезают. Однако с возрастом может возникнуть необходимость повторных реконструктивных операций.
Отсутствие дуги аорты дистальнее левой подключичной артерии (тип или между левой общей сонной и левой подключичной артериями (тип может сочетаться практически с любым другим Пороки сердца врождённые, чаще с дефектом межжелудочковой перегородки. Дистальная часть аорты после её перерыва получает кровь через артериальный проток. В этом случае уже на первом месяце жизни развивается сердечная недостаточность, которая может привести к гибели ребёнка.
Лечение только оперативное: создание обходного анастомоза с одновременной радикальной или паллиативной коррекцией сопутствующего порока сердца.
Летальность сразу после операции около 50%, отдалённые результаты также неблагоприятные.
Отхождение аорты и лёгочного ствола от левого желудочка — очень редкий порок, при котором аорта может располагаться справа, спереди или слева от лёгочного ствола. Практически всегда имеется стеноз лёгочного ствола. Мышечный подклапанный конус может отсутствовать. Сохранение жизни зависит от наличия дефекта межжелудочковой перегородки. Оперативное лечение проводится в условиях искусственного кровообращения: дефект межжелудочковой перегородки закрывают заплатой, лёгочный ствол отсекают, ушивают отверстие левого желудочка, а затем с помощью кондуита с искусственным клапаном правый желудочек соединяют с дистальной частью лёгочного ствола.
Отхождение аорты и лёгочного ствола от правого желудочка (синонимы: простая транспозиция аорты, двойной отток из правого желудочка).
Лёгочный ствол развит нормально и начинается в выходном отделе (артериальном конусе, Т.) правого желудочка. Аорта отходит от синусной части правого желудочка, выше наджелудочкового гребня, под которым располагается дефект межжелудочковой перегородки. Ствол пучка Гиса проходит по нижнему краю дефекта перегородки. Правый желудочек резко гипертрофирован. Иногда наблюдается гипертрофия левого желудочка (при малых размерах дефекта межжелудочковой перегородки). У подавляющего большинства больных этот порок сочетается со стенозом инфундибулярного отдела правого желудочка.
Нарушения гемодинамики во многом определяются состоянием подклапанного пространства лёгочного ствола. Если инфундибулярный стеноз отсутствует, то наблюдается лёгочная гипертензия (давление может быть равно аортальному). При этом выраженной гипоксемии не бывает, так как кровоток в полости правого желудочка имеет физиологическое направление: через дефект межжелудочковой перегородки в аорту и из полости правого желудочка в лёгочный ствол. Перемешивание крови незначительное. При наличии инфундибулярного стеноза давление в правом желудочке повышается, происходит попадание венозной крови в аорту, в связи с этим возникает гипоксемия и цианоз. Минутный объем малого круга уменьшен.
При сочетании порока с инфундибулярным стенозом лёгочного ствола клинические, картина во многом сходна с тетрадой Фалл о — цианоз, одышка, утомляемость. Сердце увеличено в размерах, в третьем-четвёртом межреберье слева от грудины выслушивается интенсивный систолический шум, вызванный не только стенозом, но и сбросом крови через дефект межжелудочковой перегородки. Клинические, картина порока без стеноза лёгочного ствола напоминает дефект межжелудочковой перегородки с выраженной лёгочной гипертензией: лёгкий цианоз, неинтенсивный систолический шум над сердцем, акцентированный монофазный II тон над лёгочным стволом.
На ЭКГ отмечаются признаки перегрузки правого или обоих желудочков с поворотом электрической оси сердца вправо, если дефект межжелудочковой перегородки небольшой — признаки перегрузки обоих желудочков, особенно левого. При рентгенологическое исследовании: сердце увеличено в размерах, имеет округлую форму, лёгочный рисунок может быть обеднённым (при стенозе лёгочного ствола и гиповолемии малого круга кровообращения); при отсутствии стеноза рентгенологическое изменения не характерны.
При катетеризации сердца выявляется высокое давление в правом желудочке (в систолу одинаковое с давлением в аорте). При наличии стеноза лёгочного ствола отмечается большой градиент давления между желудочком и лёгочным стволом. При отсутствии стеноза давление в лёгочном стволе всегда очень высокое. Оксигенация крови в полости желудочка и сосудах зависит от соотношения давления в аорте и лёгочном стволе и от степени смешивания крови.
При контрастировании сердца можно видеть свойственные пороку направления потоков крови и сужение выходного отдела правого желудочка. Наиболее информативна левожелудочковая вентрикулография: становятся видимыми дефект межжелудочковой перегородки, аорта и лёгочный ствол. Снимки в боковых и косых проекциях позволяют установить положение сосудов относительно друг друга; обычно аорта располагается несколько кпереди от лёгочного ствола и плоскости межжелудочковой перегородки. При этом пороке наджелудочковый гребень занимает центральное положение по отношению к дефекту межжелудочковой перегородки (при тетраде Фалло гребень располагается вентрально).
Дифференциальную диагностику проводят с тетрадой Фалло (смотри полный свод знаний: Фалло тетрада), комплексом Эйзенменгера, транспозицией магистральных сосудов, трёхкамерным сердцем с единым желудочком и атриовентрикулярным каналом.
Лечение оперативное, проводится в условиях искусственного кровообращения. Дефект межжелудочковой перегородки закрывают заплатой, которая соединяет края дефекта с устьем аорты как тоннель; выходной отдел правого желудочка при наличии стеноза резецируют. При этом есть опасность создания подклапанного стеноза аорты, особенно при малых дефектах межжелудочковой перегородки, и повреждения проводящих путей сердца.
В послеоперационном периоде нередки случаи реканализации дефекта.
Пентада Фалло — сочетание анатомических аномалий, характерных для тетрады Фалло, с большим (вторичным или первичным) дефектом межпредсердной перегородки. При пентаде Фалло через дефект межпредсердной перегородки происходит дополнительный сброс крови (рисунок 1, к). Направление и величина его определяются соотношением давления в предсердиях. Чаще наблюдается венозно-артериальный сброс крови. При пентаде Фалло, как правило, левый желудочек имеет нормальные размеры и форму, а если и бывает его гипоплазия, то незначительная.
Клинические, картина, диагноз, лечение, исходы практически аналогичны таковым при тетраде Фалло (смотри полный свод знаний: Фалло тетрада).
Первичный дефект межпредсердной перегородки представляет собой полулунное отверстие, расположенное над клапанами, протяжённостью от аорты до передней стенки предсердия (коронарного синуса). Нередко при этом расщеплена передняя створка митрального клапана или перегородочная створка трёхстворчатого (правого предсердно-желудочкового) клапана либо обе створки.
Основные патофизиологические нарушения, клинические, картина и диагноз аналогичны таковым при вторичном дефекте межпредсердной перегородки больших размеров. Отличием является то, что при первичном дефекте перегородки на ЭКГ наблюдается отклонение электрической оси влево при наличии диастолической перегрузки правого желудочка и неполной блокады правой ножки пучка Гиса.
Лечение только оперативное: в условиях искусственного кровообращения на «открытом» сердце подшивают заплату к краям межпредсердной перегородки и фиброзному кольцу клапанов. Летальность после операции около 3%. Возможно возникновение нарушений ритма сердца (атриовентрикулярная блокада). В отдалённые сроки после операции большинство пациентов (80—90%) практически здоровы.
Периферический стеноз лёгочного ствола — локальное или множественное сужение правой или левой лёгочной артерии — часто сочетается с клапанным стенозом лёгочного ствола, тетрадой Фалло, дефектом межжелудочковой перегородки или артериальным протоком. Присущие только этому пороку клинические, признаки отсутствуют. При катетеризации сердца и контрастном исследовании можно определить величину градиента давления и уровни сужения. При отсутствии других Пороки сердца врождённые оперативное вмешательство не показано. Надклапанное сужение или гипоплазию лёгочного ствола устраняют во время операции по поводу других врождённых пороков сердца вшиванием в область сужения заплаты из аутоперикарда или синтетического материала.
Полная транспозиция аорты и лёгочного ствола — порок, при котором основным признаком является транспозиция сосудов с передним расположением устья аорты по отношению к лёгочному стволу. Возможны два варианта: аорта расположена по правому контуру сердца (d-транспозиция); аорта проходит по левому контуру сердца (1-транспозиция).
Различают полную, корригированную, и неполную (аномалию Тауссиг — Бинга) транспозицию, а также её сочетания с другими Пороки сердца врождённые При полной транспозиции аорта начинается из венозного, а лёгочный ствол из артериального желудочка.
При полной транспозиции сосудов всегда имеется связь между обоими кругами кровообращения в виде либо дефекта перегородок, либо аномального впадения лёгочных вен, либо открытого артериального протока или аортолёгочного свища. Возможны сообщения на нескольких уровнях. Наиболее часто встречаются дефекты межжелудочковой перегородки, открытый артериальный проток и дефект межпредсердной перегородки. При полной транспозиции диаметры аорты и лёгочного ствола чаще одинаковые. В большинстве случаев нисходящая часть аорты занимает обычное положение. Коронарные артерии отходят от аорты (левая от левого, правая от правого синуса аорты), располагаясь между аортой и правым предсердием. При зеркальном расположении желудочков (редкий вариант) аорта отходит от венозного желудочка (правого по отношению к межжелудочковой перегородке), который по своему строению соответствует левому желудочку. Полная транспозиция сосудов нередко сочетается с аномалией расположения сердца.
При полной транспозиции сосудов имеют место сообщение обоих кругов кровообращения в связи с дефектом перегородок сердца, большой минутный объем сердца и резкая гипоксемия (смотри полный свод знаний: Гипоксия). При полном разделении кругов кровообращения новорожденные нежизнеспособны. При неполном разделении (дефекты перегородок сердца) происходит перекрёстное шунтирование крови: артериальная кровь попадает в аорту, венозная — в лёгкие. Артериовенозный шунт всегда равен венозно-артериальному, так как иначе произошло бы перемещение крови в один из кругов кровообращения. В течение сердечного цикла и различных фаз дыхания направление шунта может меняться. Если у больного дефекты обеих перегородок (межпредсердной и межжелудочковой), направление шунта может быть обратным по сравнению с нормальным. Однако объем сбрасываемой крови практически одинаков.
Тяжесть нарушений гемодинамики имеет обратную зависимость с величиной перекрёстного шунта. Чем меньше происходит перемешивание крови, тем выраженнее гипоксемия, больше минутный объем сердца, более вероятна сердечная недостаточность. Величина сброса определяется периферическим сосудистым сопротивлением, наличием и степенью сужения на путях оттока из сердца, размерами дефектов перегородок, наличием артериального протока. Наиболее благоприятным для гемодинамики этого порока является сочетание дефектов межпредсердной и межжелудочковой перегородок. При отсутствии стеноза лёгочного ствола сравнительно быстро развивается лёгочная гипертензия.
Основные признаки порока — резкий цианоз, одышка в покое, утомляемость, сердцебиение, сердечная недостаточность (гепатомегалия, отеки), частые респираторные заболевания, заметное отставание в физическом развитии. Характер проявлений зависит от степени наполнения малого круга кровообращения. При усиленном лёгочном кровотоке у больных часто возникают заболевания верхних дыхательных путей, цианоз резко выражен, наблюдаются приступы одышки. Дети малоподвижны. Заметны пульсация шейных вен, «сердечный горб». Границы сердца резко увеличены, выслушивается акцентированный II тон над лёгочным стволом.
Полная транспозиция с обеднённым лёгочным кровотоком протекает легче и по клинические, картине напоминает тетраду Фалло. Недостаточность кровообращения возникает в раннем детском возрасте.
Для этого порока характерно высокое содержание гемоглобина (более 330 грамм/литров), эритроцитов (до 11 000 000), увеличение гематокритного числа. На ЭКГ — крайняя степень отклонения электрической оси сердца вправо, резкая гипертрофия правого желудочка, нарушения внутрисердечной проводимости, иногда перегрузка левого желудочка, нарушения сердечного ритма.
При рентгенологическое исследовании в случаях увеличенного лёгочного кровотока обнаруживают усиление лёгочного рисунка, особенно в прикорневом отделе. Тень сердца расширена (овоидной конфигурации), в передней проекции отсутствует дуга лёгочного ствола. Увеличена пульсация правого желудочка. При сниженном лёгочном кровотоке тень сердца расширена менее значительно.
Катетеризация сердца позволяет обнаружить признаки транспозиции: высокое насыщение крови кислородом в лёгочном стволе и прохождение катетера из правого желудочка в аорту (при положении катетера близко к грудине), высокое давление в правом желудочке (в левом, как и в лёгочном стволе, оно может быть низким или слегка повышенным). При заполнении контрастным веществом правого желудочка происходит интенсивное контрастирование аорты, при заполнении левого желудочка — лёгочного ствола.
У «синих» больных с усиленным лёгочным кровотоком дифференциальную диагностику проводят с комплексом Эйзенменгера, общим артериальным стволом, атрезией трёхстворчатого клапана, единым желудочком сердца, аномалией Тауссиг — Бинга; при обеднённом кровотоке — с тетрадой Фалло, двойным отхождением аорты и лёгочного ствола от правого желудочка, корригированной транспозицией крупных сосудов с дефектом межжелудочковой перегородки и стенозом лёгочного ствола.
Лечение оперативное, оно может быть паллиативным или радикальным. К паллиативным операциям относится создание сосудистых анастомозов или искусственного дефекта межпредсердной перегородки (кавопульмональный анастомоз, перемещение устьев правых лёгочных вен в правое предсердие с наложением соустья между нижней полой веной и левым предсердием). Детям с выраженным цианозом (насыщение кислородом артериальной крови менее 75%) и явлениями сердечной недостаточности показано создание или расширение дефекта межпредсердной перегородки баллонным катетером (операция Рашкинда): катетер проводят в левое предсердие, раздувают баллон на его конце, после чего смещают в правое предсердие — при этом происходит либо разрыв перегородки, либо расширение овального окна. Баллонную септостомию лучше провести в возрасте до 3 месяцев, так как затем межпредсердная перегородка становится более толстой и прочной.
Радикальная операция — создание искусственного дренирования полых вен в левый желудочек и лёгочный ствол. Для этого лоскут из аутоперикарда или пластического материала после предварительного иссечения межпредсердной перегородки подшивают изнутри к стенке общего предсердия таким образом, чтобы соединить устья полых вен и митрального клапана. Этим достигается сообщение лёгочных вен с правым желудочком и аортой, благодаря чему создаётся корригированная транспозиция крупных сосудов. Дефект межжелудочковой перегородки может быть закрыт из доступа через предсердие. В тех случаях, когда такой доступ оказывается недостаточным для закрытия дефекта межжелудочковой перегородки, прибегают к вентрикулотомии. Обструктивные поражения устраняются через стенку сосуда.
При транспозиции крупных сосудов, дефекте межжелудочковой перегородки и сужении лёгочного ствола проводят следующую операцию. Лёгочный ствол отсекают от левого желудочка, в выходном отделе правого желудочка производят поперечный разрез, а в полости правого желудочка к краям дефекта и устью аорты подшивают заплату, благодаря которой кровь направляется из левого желудочка в аорту. К краям разреза желудочка и лёгочного ствола подшивают кондуит, через который кровь из правого желудочка поступает в лёгочные сосуды. При подшивании заплаты следует опасаться возможности создания подклапанного стеноза аорты.
После баллонной септостомии насыщение артериальной крови кислородом повышается. Послеоперационная летальность не превышает 10%. Несмотря на это, дети не переживают более 30 месяцев, если не производится радикальная операция. Летальность после радикальной операции у детей с транспозицией сосудов и дефектом межпредсердной перегородки в возрасте от 3 месяцев до 1 года — 5—10%; в возрасте от 1 года — выше. После радикальной операции у детей с транспозицией сосудов и сопутствующим дефектом межжелудочковой перегородки или стенозом выходного отдела левого желудочка летальность возрастает до 20—30%. Почти у половины больных возникают суправентрикулярные аритмии, связанные с высокой активностью синусно-предсердного узла (узла Ашоффа — Тавары). Во избежание этого осложнения прибегают к множественным рассечениям проводящих путей, идущих от синусно-предсердного узла.
Поздние осложнения после радикальных операций — сужение устья верхней полой вены (отверстия верхней полой вены), нарастание венозной лёгочной гипертензии, нарастающая обструкция выхода из обоих желудочков (в тех случаях, когда использован кондуит).
Прорыв аневризмы синуса Вальсальвы приводит к сообщению аорты с одним из отделов сердца. Это один из редких врождённых пороков сердца. В 75% случаев наблюдается у лиц мужского пола. Разрыв истончённой стенки чаще всего наступает в возрасте 30—50 лет и редко в первые 10 лет жизни. Возникновение его связано с врождённым недоразвитием участка стенки устья аорты, при котором средняя оболочка полностью отсутствует или не срастается с фиброзным кольцом клапанов аорты.
Порок в большинстве случаев развивается в правом коронарном синусе, реже в заднем (некоронарном) синусе, иногда распространяется на два. Вовлечение в процесс левого синуса аорты наблюдается в 5% случаев. Отсутствие на ограниченном участке средней оболочки приводит к истончению аортальной стенки и её выбуханию под действием давления (рисунок 1, з). Аневризмы правого синуса в основном (75%) локализуются в его левой трети, нередко сочетаясь с надгребневым дефектом межжелудочковой перегородки, расположенным у самого клапана лёгочного ствола. Аневризмы заднего синуса аорты обычно формируются в его левой трети. Вследствие таких взаимоотношений прорыв аневризмы происходит в сердечные полости (рисунок 15): в правый желудочек — в 70% случаев, правое предсердие — в 20% случаев и реже в левый желудочек или лёгочный ствол. Аневризмы правой и центральной части правого синуса прорываются в выходной отдел правого желудочка, из задней части синуса — во входной отдел под перегородочную створку трёхстворчатого клапана. Редко могут быть прорывы в правое предсердие или левый желудочек.
Врождённые аневризмы синуса Вальсальвы, как правило, небольшие по размерам, поэтому они длительное время протекают бессимптомно, не создавая препятствий для кровотока. Очень редко аневризма, внедряясь в выходной отдел правого желудочка, может вызвать его сужение. После прорыва аневризмы кровь начинает поступать из аорты в правые отделы сердца как в систолу, так и в диастолу. Величина шунта всецело зависит от размеров разрыва. Большой артериовенозный сброс крови вызывает развитие сердечной недостаточности. Шунтирование крови в диастолу приводит к резкому падению диастолического давления, что сразу же отражается на коронарном кровотоке. Возникает дефицит коронарного кровообращения (смотри полный свод знаний) с типичными проявлениями в виде ишемических болей в сердце.
В некоторых случаях прорыв аневризмы протекает незаметно, и лишь спустя несколько дней или недель появляются симптомы порока. Наиболее характерным признаком прорыва аневризмы синуса Вальсальвы является развитие коллапса: на фоне полного здоровья неожиданно появляются интенсивные боли за грудиной, резкая одышка, тахикардия, головокружение. Прорыву способствует стрессовая нагрузка, вызывающая подъём АД, однако это может произойти и в покое. Обычно боли не иррадиируют в шею, руку или лопатку (в отличие от инфаркта миокарда). Резкая одышка, по-видимому, связана с внезапной гиперволемией малого круга кровообращения, недостаточностью кровообращения, выраженной тахикардией. В терминальном периоде развивается картина нарастающей сердечной недостаточности с расширением сердца, гепатомегалией, отёками, цианозом.
При физикальном обследовании — непрерывное («машинное») дрожание и систолодиастолический шум в прекардиальной области, большое пульсовое давление, высокое венозное давление, признаки недостаточного кровообращения. Усилен сердечный толчок, увеличены размеры сердца, тахикардия. Оба тона акцентированы, II тон расщеплен. На ЭКГ признаки перегрузки правого желудочка, а позже обоих желудочков, иногда с перегрузкой предсердий. Возникают нарушения сердечного ритма — атриовентрикулярная блокада, узловой ритм, блокада правой ножки пучка Гиса.
 |
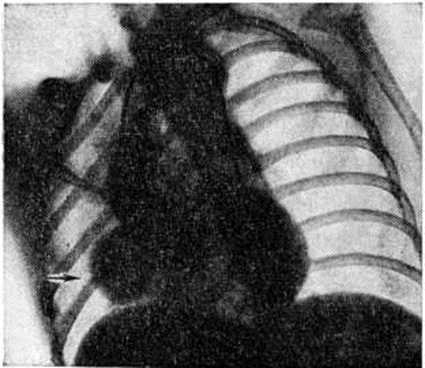
|  |
Рис. 16. | ||
Обычно при рентгенологическое исследовании врождённая аневризма синуса Вальсальвы до разрыва не распознается. Появление артериовенозного шунта сопровождается дилатацией отделов сердца и резким усилением прикорневого рисунка лёгких. При сбросе крови в правое предсердие это предсердие и лёгочный ствол значительно расширяются.
Катетеризация сердца и его контрастирование позволяют правильно распознать порок и определить величину аортального сброса крови. Повышение оксигенации крови в правых отделах сердца, сброс, установленный красочной, термодилюционной, платиноводородной пробами, повышение давления в правых отделах сердца и лёгочном стволе являются признаками порока. При контрастировании левых отделов сердца виден сброс крови на уровне аорты. На аортограммах (рисунок 16) в левой косой или боковой проекции выявляется расширенный синус: полость аневризмы и свищ в один из правых отделов сердца.
Дифференциальную диагностику проводят с пороками, при которых возникает систолодиастолический шум над сердцем (открытым артериальным протоком, коронарной артериовенозной фистулой, дефектом межжелудочковой перегородки с недостаточностью клапана аорты, аортальной недостаточностью, аортопульмональным свищом, аномалией коронарных артерий, артериовенозными аневризмами артерий грудной стенки).
Лечение только оперативное. Закрытие прорыва производят в условиях искусственного кровообращения через правые отделы сердца либо через стенку аорты. Отверстие ушивают или закрывают с помощью заплаты.
Летальность после оперативного лечения не превышает 5%. Подавляющее большинство оперированных в отдалённые сроки практически здоровы. Лишь у отдельных больных возникает реканализация, и тогда требуется повторное оперативное вмешательство.
Синдром Лютамбаше — дефект межпредсердной перегородки в сочетании с митральным стенозом (врождённым, приобретённым). Наблюдается редко. Фиброзное кольцо митрального клапана, как и левый желудочек, может быть гипоплазированным. Дефект межпредсердной перегородки (чаще открытое овальное окно) является вторичным. Гемодинамические нарушения при синдроме Лютамбаше характеризуются особенно высокой величиной артериовенозного шунта. Клинические, картина отличается быстрым прогрессированием нарушений деятельности сердца. Для диагностики порока используют те же методы, что и при вторичном дефекте межпредсердной перегородки. Особенно важное значение имеет нечёткость симптомов митрального стеноза и сравнительно большой артериовенозный сброс крови при малом размере дефекта перегородки (по данным катетеризации сердца). При синдроме Лютамбаше оперируют на «открытом» сердце; вначале выполняют митральную комиссуротомию, а затем закрывают дефект межпредсердной перегородки. Исходы обычно удовлетворительные.
Стеноз лёгочного ствола. Изолированный стеноз лёгочного ствола встречается среди Пороки сердца врождённые у новорождённых в 8,9%, в школьном возрасте в 17,5—20% случаев, одинаково часто у мальчиков и девочек.
Различают два типа стеноза лёгочного ствола: клапанный и инфундибулярный. Клапанный стеноз встречается в 95% случаев. У большинства больных сросшийся по створкам клапан имеет центральное отверстие. Реже клапан состоит из двух изменённых (плотных, частично сросшихся) створок или имеет гипоплазию фиброзного кольца. Инфундибулярный стеноз часто сочетается с клапанным сужением и представляет собой разрастание плотной фиброзной и мышечной ткани выходного тракта правого желудочка. При этом различают несколько форм стеноза: на уровне наджелудочкового гребня межжелудочковой перегородки (образуется как бы третья желудочковая полость); вблизи от фиброзного кольца клапанов лёгочного ствола; стволовое сужение от наджелудочков ого гребня до клапана; в виде резкой гипертрофии гребня, мясистых трабекул и передней стенки желудочка. Возможно одновременное сочетание клапанного и подклапанного стенозов лёгочного ствола.
Сильная узкая (вследствие стеноза) струя крови, выбрасываемая из правого желудочка, создаёт турбулентный ток крови и дилатацию лёгочного ствола (смотри полный свод знаний), то есть постстенотическое расширение. С возрастом фиксированное фиброзной тканью отверстие становится все большим препятствием для работы сердца, что приводит к нарастанию градиента давления (в правом желудочке и лёгочном стволе).
Большинство детей с умеренным изолированным стенозом лёгочного ствола растут и развиваются нормально. Некоторые из них жалуются на повышенную утомляемость и одышку при физических нагрузках. С нарастанием степени стеноза появляются боли в груди ангинозного характера, головокружение, резкая одышка.
У больных с выраженным стенозом развивается правожелудочковая недостаточность. Дети отстают в физическом развитии. Иногда у них возникают обмороки гипоксического происхождения.
У новорождённых резкий стеноз приводит к венозно-артериальному шунтированию крови через открытое овальное окно (в этом случае не отмечается прямой зависимости между степенью стеноза и силой систолического шума), развивается кардиомегалия, увеличивается печень, нарастает цианоз.
Данные ЭКГ свидетельствуют о гипертрофии правого желудочка и его систолической перегрузке, гипертрофии правого предсердия; эти изменения пропорциональны степени сужения лёгочного ствола и гипертензии в правом желудочке.
На фонокардиограмме регистрируется высокочастотный систолический шум во втором межреберье слева ромбовидной формы (рисунок 17). Интенсивность шума пропорциональна степени сужения. Лёгочный компонент II тона ослаблен и фиксируется позднее аортального. У больных с умеренной степенью клапанного сужения лёгочного ствола виден щелчок открытия этого клапана и начало выброса крови. Отмечается усиленная пульсация правого желудочка.
При рентгенологическое исследовании практически всегда выявляется дилатация лёгочного ствола, увеличение правого желудочка, правого предсердия (рисунок 18). Степень кардиомегалии не коррелирует с ростом давления в правом желудочке. Периферический лёгочный рисунок обеднён или нормален.
 |
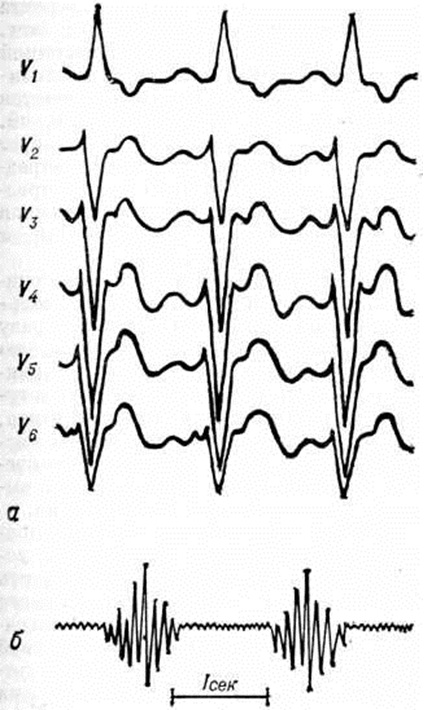
|  |
Рис. 17. | ||
 |
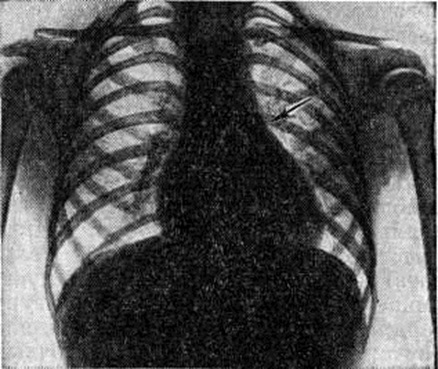
|  |
Рис. 18. | ||
 |
|  |
Рис. 1, 3. | ||
Катетеризация и контрастное исследование сердца дают представление о величинах давления и градиенте давления на уровне сужения, а также позволяют исключить другие пороки сердца. Давление в правом желудочке при резко выраженном стенозе может превышать давление в левом желудочке. При селективном контрастировании правого желудочка в левой косой или боковой проекции видны локализация сужения, гипоплазия устья лёгочного ствола, гипертрофия миокарда правого желудочка; по этим же данным можно судить о сократительной способности миокарда.
В раннем детском возрасте стеноз лёгочного ствола необходимо дифференцировать с небольшим дефектом межжелудочковой перегородки и тетрадой Фалло (смотри полный свод знаний: Фалло тетрада); у новорождённых — с аортальным стенозом, лёгочной атрезией, трикуспидальной атрезией, тетрадой Фалло и гипоплазией правого желудочка.
В раннем детском возрасте при острой правожелудочковой недостаточности или приступах одышки показано срочное оперативное вмешательство; оперативное вмешательство у детей и взрослых производится при градиенте давления на уровне сужения, превышающем 60 миллиметров рт. ст.
Открытую лёгочную вальвулотомию производят в условиях искусственного кровообращения и гипотермии, причём менее рискована и более проста операция в условиях умеренной гипотермии. Доступ к клапану — продольный разрез передней стенки лёгочного ствола. Сужение устраняют рассечением клапана по комиссурам до фиброзного кольца, стремясь не вызвать недостаточности клапана. Подклапанный стеноз устраняют в условиях искусственного кровообращения. Доступ к клапану — через правые желудочек или предсердие. Фиброзно-мышечные массивы, суживающие выход из желудочка, иссекают. При узком фиброзном клапанном кольце для увеличения его периметра показано вшивание заплаты из аутоперикарда или синтетического материала. Обнаруженный в ходе операции дефект межпредсердной перегородки (овальное окно) закрывают через правое предсердие.
Непосредственная летальность у детей и взрослых после операций с применением искусственного кровообращения составляет 2—3%, в условиях гипотермии — до 0,5%. Если подклапанный стеноз устранён не полностью (при контрольной манометрии регистрируется высокое давление в правом желудочке, градиент давления сохраняется), послеоперационный период осложняется правожелудочковой недостаточностью. Более 90% оперированных больных в отдалённые сроки практически здоровы, жалобы отсутствуют, ЭКГ и рентгенологическое показатели нормальные. Однако у большинства оперированных сохраняется слабый шум, иногда в сочетании с протодиастолическим шумом — аускультативные признаки недостаточности клапана. Примерно у 10% сохраняются заметные клинические, признаки стеноза.
Тетрада Фалло. Врождённый порок сердца, при котором стеноз лёгочного ствола сочетается с дефектом межжелудочковой перегородки, декстропозицией аорты, «сидящей» над дефектом этой перегородки (рисунок 1, л). Сопровождается резкой гипертрофией правого желудочка. Имеется множество анатомических вариантов порока, зависящих от выраженности отдельного его компонента. Гемодинамические нарушения обусловлены венозно-артериальным шунтированием и гиповолемией малого круга кровообращения (цветной рисунок 1—3). Лечение оперативное (смотри полный свод знаний: Фалло тетрада).
Трёхкамерное сердце с единым желудочком (синонимы: единый желудочек, единственный желудочек с рудиментарной выводной полостью). В основе порока лежит полная агенезия межжелудочковой перегородки. Среди Пороки сердца врождённые встречается в 2% случаев. Порок возникает в первые 8 недель эмбрионального развития, в период формирования аортопульмональной перегородки и луковицы аорты. При этом сохраняется мышечный гребень, отделяющий примитивный желудочек от луковицы, от которого отходят один или оба магистральных артериальных сосуда. Межжелудочковая перегородка не развивается, в результате чего полость желудочков остаётся неразделённой.
Два раздельных нормально сформированных предсердия открываются в единую полость желудочка, из которого берут начало аорта и лёгочный ствол, в 90% случаев имеющие полную транспозицию. Иногда один из магистральных сосудов может начинаться из рудиментарного образования — мышечной полости («выпускника»), чаще располагающейся на передней стенке общего желудочка. В эту полость кровь из желудочка попадает через одно или несколько отверстий в гребне, формирующем вход в «выпускник» (рисунок 1, и). Магистральный сосуд, отходящий от него, обычно гипоплазирован. Межжелудочковая перегородка либо отсутствует, либо представлена в виде небольшого мышечного валика. Число сосочковых мышц увеличено, сухожильные хорды удлинены. Иногда встречается прикрепление сосочковых мышц трёхстворчатого клапана к краям отверстия, ведущего в «выпускник» (так называемый сердце Ламбера). Предсердно-желудочковый пучок располагается в задней стенке желудочка. У V4 больных развивается стеноз лёгочного ствола (в половине случаев — клапанный). В 80% случаев порок сочетается с дефектом межпредсердной перегородки (иногда полным отсутствием её), нередко аномальное положение сердца.
В зависимости от морфологии порока и связанного с нею характера гемодинамических нарушений выделяют пять форм порока. I, или классическая, форма (80% случаев) — из рудиментарного «выпускника», лежащего по левому контуру сердца, выходит гипоплазированная аорта; резко расширенный лёгочный ствол выходит из желудочка справа и сзади от аорты; II форма — оба сосуда начинаются от единого желудочка; III форма — из «выпускника» выходит гипоплазированный лёгочный ствол, транспозиция сосудов отсутствует (так называемый сердце Холмса); IV форма — лёгочный ствол и аорта берут начало от «выпускника»; V форма — сердце Ламбера.
Гемодинамические нарушения варьируют в зависимости от формы патологии. При I форме большая часть крови попадает в малый круг, кровь хорошо смешивается в единой полости. Гиперволемия малого круга создаёт условия для достаточного насыщения крови кислородом. У больных сравнительно быстро развивается лёгочная гипертензия. При других (II—V) формах, когда имеется стеноз лёгочного ствола, характерна нарастающая гипоксемия большого круга кровообращения.
Порок может протекать без цианоза и с цианозом. У больных без цианоза заметно отставание в физическом развитии, цианоз появляется у них при нагрузках. Над сердцем выслушивается систолический шум, II тон усилен во втором межреберье.
Данные ЭКГ не имеют патогномоничных признаков порока.
При рентгенологическое исследовании отмечаются признаки гиперволемии или, наоборот, гиповолемии малого круга кровообращения. Форма сердца округлая, верхушка приподнята над диафрагмой. На месте лёгочного ствола (II дуга сердца) выбухание, соответствующее «выпускнику». В отдельных случаях сердце резко увеличено.
При катетеризации сердца выявляется прибавление оксигенированной крови и высокое давление в желудочке. Селективное контрастирование желудочка позволяет увидеть единую полость, дополнительную полость («выпускник»), оба сосуда, определить их локализацию. Отсутствие межжелудочковой перегородки устанавливают в левой косой или боковой проекции.
У новорождённых для профилактики развития лёгочной гипертензии показана операция суживания лёгочного ствола. Во время радикальной операции, проводимой обычно в возрасте более 10 лет (если она возможна по анатомическим взаимоотношениям и при невысоком сосудисто-лёгочном сопротивлении), выявляют проводящие пути (во избежание их повреждения) и разделяют желудочек на две полости с помощью заплаты из синтетического материала или аутоперикарда. При других формах трёхкамерного сердца с единым желудочком возможна только гемодинамическая коррекция порока с использованием кондуита.
При наличии противопоказаний к радикальной коррекции порока производят паллиативные операции, направленные на увеличение кровенаполнения малого круга кровообращения (меж сосудистые анастомозы).
Послеоперационная летальность высокая.
Трёхпредсердное сердце — редкий порок, при котором лёгочные вены, как правило, впадают в добавочную полость левого предсердия, соединяющуюся отверстием с нормальным по своим размерам левым предсердием. Застойные явления и гипертензия в лёгочных венах влияют на развитие лёгочной и правожелудочковой гипертензии.
Больные с этим пороком страдают выраженной одышкой и частыми респираторными заболеваниями. Обычно над верхушкой сердца шума и диастолического дрожания не бывает. При катетеризации сердца находят лёгочную гипертензию при нормальном давлении в левом предсердии. Морфологически изменения лучше всего выявляются при киноангиокардиографическом исследовании.
Лечение оперативное, направлено на иссечение стенки, разделяющей левое предсердие и добавочную предсердную камеру. Операция выполняется в условиях искусственного кровообращения. Без оперативного вмешательства более половины больных погибает.
Триада Фалло — врождённый порок сердца, при котором стеноз лёгочного ствола сочетается с дефектом межпредсердной перегородки (или открытым овальным окном этой перегородки). Сопровождается венозно-артериальным шунтированием, как и при тетраде Фалло (рисунок 1, м). Лечение оперативное (смотри полный свод знаний: Фалло триада).
Трикуспидальная атрезия — полное отсутствие трёхстворчатого клапана. Встречается у 1—2% новорождённых с Пороки сердца врождённые При этом в большинстве случаев правый желудочек гипоплазирован, имеются небольшой дефект межжелудочковой перегородки, стеноз или гипоплазия клапана лёгочного ствола. Иногда дефекта межжелудочковой перегородки нет, иногда он большой; стеноза лёгочной артерии может не быть. Приблизительно у 25% больных отмечается транспозиция крупных артерий. Кровоток осуществляется через овальное окно или дефект межпредсердной перегородки. В левом предсердии и левом желудочке венозная и лёгочная кровь смешиваются и поступают в аорту.
У новорождённых с трикуспидальной атрезией вследствие уменьшения лёгочного кровотока сразу после рождения или в первую неделю жизни появляется цианоз. Характерны тахикардия, одышка, приступы гипоксии, отсутствие аппетита, ацидоз. Обычно выслушивается систолический шум. Печень увеличена. Определяются эритроцитоз, высокая концентрация гемоглобина.
На ЭКГ выявляется левожелудочковая гипертрофия. Рентгенологические исследование позволяет обнаружить значительную дилатацию левого предсердия (атриомегалию), лёгочный рисунок ослаблен, в боковой проекции правый желудочек отсутствует. При катетеризации сердца обнаруживают, что давление в правом предсердии выше, чем в левом. После контрастирования правого предсердия становятся видимыми левое предсердие, левый желудочек и оба артериальных сосуда, иногда правый желудочек.
Дифференцировать трикуспидальную атрезию необходимо с тетрадой Фалло, гипоплазией правого желудочка, атрезией лёгочного ствола, единым желудочком, атриовентрикулярным каналом, транспозицией крупных артерий, если они сочетаются со стенозом лёгочного ствола.
Большинство новорождённых с трикуспидальной атрезией погибает во время приступа гипоксии (смотри полный свод знаний). Выжившим больным с уменьшенным лёгочным кровотоком показаны паллиативные операции, увеличивающие кровенаполнение лёгочных сосудов. Если дефект межпредсердной перегородки небольшой, целесообразна баллонная септостомия. Одним из наиболее эффективных вмешательств является наложение кавопульмонального анастомоза (противопоказан у тех новорождённых, у которых сохраняется высокое легочно-сосудистое сопротивление). При нормальном легочно-сосудистом сопротивлении накладывается анастомоз между правым предсердием и лёгочным стволом через кондуит, при этом дефект межпредсердной перегородки полностью закрывают, лёгочный ствол перевязывают. Если ранее был наложен кавопульмональный анастомоз, то кондуит подшивают дистальным концом в левую лёгочную артерию, в результате чего кровь попадает в лёгкие, минуя правый желудочек. Послеоперационная летальность более 30%. Непосредственный послеоперационный период протекает тяжело, с асцитом (смотри полный свод знаний), гидротораксом (смотри полный свод знаний), гепатомегалией.
Врождённые пороки сердца у взрослых
Наиболее частыми Пороки сердца врождённые у взрослых являются: артериальный проток, дефекты межпредсердной и межжелудочковой перегородок, пороки типа Фалло, коарктация аорты.
Классификация Пороки сердца врождённые у взрослых: неосложнённые пороки; пороки с выраженными вторичными изменениями сердца и сосудов, крайней лёгочной гипертензией; пороки, осложнённые эндокардитом или его последствиями; пороки, осложнённые заболеваниями других органов.
Одним из самых частых патологический состояний малого круга кровообращения при Пороки сердца врождённые у взрослых является лёгочная гипертензия, обусловленная сбросом крови и структурными изменениями лёгочных сосудов. Крайняя стадия лёгочной гипертензии — синдром Эйзенменгера — характеризуется высоким давлением в лёгочном стволе (на уровне АД в большом круге кровообращения и даже выше) и сбросом венозной крови в артериальное русло. Такие нарушения гемодинамики обычно сопровождаются цианозом, эритроцитозом и гемоглобинемией. Синдром Эйзенменгера у взрослых может развиться при всех Пороки сердца врождённые с повышенным лёгочным кровотоком. Наиболее характерна лёгочная гипертензия при дефекте межжелудочковой перегородки и артериальном протоке. Частота лёгочной гипертензии различна в разном возрасте: чем старше больные, тем чаще развивается у них лёгочная гипертензия с обратным сбросом.
Отличия клинические, картины Пороки сердца врождённые у взрослых обусловлены не только развитием выраженных вторичных изменений, но и сопутствующим эндокардитом, комбинацией врождённых и приобретённых изменений сердца. Тяжесть состояния больных во многом зависит от степени наполнения кровью малого круга кровообращения. Относительно легко переносятся пороки, при которых кровообращение в лёгких не изменено. Более тяжело протекают пороки с увеличенным или недостаточным лёгочным кровотоком. Нарушения гемодинамики, кислородное голодание особенно резко сказываются при физической нагрузке. Больные с уменьшенным лёгочным кровотоком редко доживают до выраженных вторичных изменений.
Вторичные изменения со стороны сердца и сосудов малого круга кровообращения, характерные для Пороки сердца врождённые с увеличенным лёгочным кровотоком, затрудняют диагностику пороков при обычных методах исследования. Определения вида анатомического изменения сердца недостаточно для выбора наиболее эффективного метода помощи взрослым. Не менее важно выявить степень снижения функциональной способности системы кровообращения.
При неосложнённых пороках с явными нарушениями гемодинамики показана хирургическая коррекция. Пороки сердца врождённые с выраженными вторичными изменениями сердца и сосудов, лёгочной гипертензией, чаще всего сопровождающиеся обратным (справа налево) сбросом, коррекции не подлежат. При пороках, осложнённых эндокардитом или его последствиями, необходимо оперативное вмешательство. В некоторых случаях ему должна предшествовать энергичная антибактериальная терапия. При сочетании врождённого и приобретённого пороков показана полная коррекция нарушений гемодинамики; расчленять вмешательство при этом не рекомендуется. У больных с пороками, осложнёнными заболеванием других органов, показания для хирургической коррекции определяются с большой осторожностью: надо решить, какой процесс является ведущим; как правило, вначале необходима терапия сопутствующих заболеваний. Иногда из-за тяжести состояния коррекция оказывается невыполнимой.
Средняя продолжительность жизни неоперированных больных с Пороки сердца врождённые— 40 лет; она всецело зависит от степени гемодинамических нарушений, тяжести присоединившихся осложнений, а также от образа жизни, физической активности и другие В отдельных случаях она может достигать 70 лет.
Артериальный проток у взрослых встречается реже, чем у детей, чаще наблюдается у женщин (соотношение больных мужского и женского пола составляет 1:3).
Проток имеет чёткую клинические, картину (интенсивный «машинный» шум, высокое АД на верхних конечностях и другие) Он может осложняться лёгочной гипертензией, бактериальным эндартериитом протока и эндокардитом, сердечно-сосудистой недостаточностью, аневризмой лёгочного ствола или протока. Осложнения изменяют клинические, течение и могут быть причиной гибели больных. При атипичном течении проток у взрослых может симулировать комбинированный митральный порок сердца, пороки аортального клапана, дефекты межжелудочковой и межпредсердной перегородок, аортопульмональный свищ, стеноз лёгочного ствола, пороки типа Фалло, артериовенозные аневризмы внутригрудных сосудов, аневризму синуса Вальсальвы с прорывом в правые отделы сердца, коарктацию аорты и другие В дифференциальной диагностике существенную помощь оказывают катетеризация сердца, ангиография.
При отсутствии противопоказаний (резкая лёгочная гипертензия со сбросом крови из лёгочного ствола в аорту, выраженные явления декомпенсации сердечной деятельности, тяжёлое сопутствующее заболевание) производят оперативное вмешательство, которое, однако, сопряжено у взрослых с повышенным риском из-за склеротических изменений стенок протока, аорты и лёгочного ствола и относится к числу сложных.
Техника закрытия артериального протока у взрослых и детей однотипна. Однако изредка у взрослых после операции наблюдается реканализация, вызываемая склеротическими изменениями протока и невозможностью его полной перевязки. Поэтому в таких случаях наиболее оправданным является пересечение протока и ушивание его концов.
В отдалённые сроки после операции у взрослых не всегда наблюдается полная реабилитация, хотя общее состояние заметно улучшается, повышается толерантность к физическим нагрузкам.
Дефекты межжелудочковой перегородки также относятся к числу часто встречающихся Пороки сердца врождённые у взрослых (до 15%). В отличие от детей у взрослых дефект обычно не бывает большим по своим размерам, хотя клинические, проявления могут быть весьма значительными (увеличение границ сердца, изменения на ЭКГ и другие). Высокое давление в лёгочном стволе, определяемое во время катетеризации сердца, свидетельствует о далеко зашедших расстройствах гемодинамики.
Эндокардит, являющийся частым осложнением этого порока у взрослых, имеет двухфазное течение. В первой фазе положительный эффект достигается обычно антибактериальной терапией; во второй (септической) фазе она почти не оказывает влияния на течение процесса. Нередко эндокардит является причиной декомпенсации сердечной деятельности.
Хирургическая коррекция дефекта межжелудочковой перегородки у взрослых показана во всех случаях с выраженной симптоматикой, в том числе и при эндокардите, особенно в септической фазе. Противопоказания: крайняя лёгочная гипертензия (давление в лёгочном стволе более 70% от давления в большом круге кровообращения) и сопутствующие заболевания.
Техника оперативного закрытия дефекта мало отличается от таковой у детей. Результаты зависят от тяжести гемодинамических нарушений перед операцией.
Дефекты межпредсердной перегородки встречаются у взрослых довольно часто (до 25% от всех Пороки сердца врождённые), нередко сочетаясь с другими Пороки сердца врождённые Как правило, проявления возникают после 15—17 лет, с возрастанием физических нагрузок. Такое доброкачественное течение порока обусловлено сравнительно поздним развитием лёгочной гипертензии, которая в этом случае вызывается только гиперволемией малого круга кровообращения.
Оперативное вмешательство целесообразно проводить в условиях искусственного кровообращения (за редким исключением, когда коррекцию порока можно произвести по закрытой методике). При больших дефектах, особенно в сочетании с аномально впадающими лёгочными венами, можно провести пластику перегородки заплатами. Разрезы стенки предсердия, стягивание перегородки при её ушивании у взрослых в 15% случаев приводят к последующим стойким нарушениям сердечного ритма.
Коарктация аорты у взрослых встречается нередко. Средняя продолжительность жизни нелеченых больных около 35 лет.
Оперативное лечение коарктации аорты у взрослых более чем в половине случаев не нормализует АД. Однако после устранения порока артериальная гипертензия протекает более доброкачественно и поддаётся гипотензивной терапии.
Пороки типа Фалло. Триада и тетрада Фалло относятся к наиболее тяжёлым Пороки сердца врождённые Средняя продолжительность жизни больных 25 лет. С возрастом увеличивается гипоксия, возрастает нагрузка на правый желудочек, увеличивается венозно-артериальный шунт. При триаде Фалло концентрическая гипертрофия правого желудочка приводит к сокращению его полости. Наблюдается развитое коллатеральное кровообращение за счёт бронхиальных артерий и сосудов грудной стенки. Этот окольный кровоток может играть основную роль в кровоснабжении лёгких.
Атипичность клинические, течения порока у взрослых обусловливается присоединившимися инфекционные осложнениями, чаще всего эндокардитом.
Диагностика пороков обычно затруднений не вызывает. Степень выраженности эритроцитоза и полигемоглобинемии указывает на тяжесть страдания. Улучшение состояния больных может быть достигнуто только оперативным путём, но в каждом случае необходимо с особым вниманием отнестись к выявлению противопоказаний, и только при безусловном их отсутствии допустима операция. В любом возрасте успех её зависит от правильного выбора метода вмешательства. Разработано и используют в практике свыше 40 вариантов паллиативных и радикальных операций и их модификаций. И тем не менее проблема коррекции этих пороков полностью ещё не разрешена. В некоторых случаях узкий лёгочный ствол и несоответствие полостей правого и левого желудочков являются препятствием для устранения порока и улучшения гемодинамики.
Стеноз лёгочного ствола у взрослых встречается чаще в сочетании с другими Пороки сердца врождённые Порок, как правило, сопровождается большим градиентом давления между правым желудочком и лёгочным стволом, а также резкой гипертрофией правого желудочка.
Единственный вид лечения — устранение сужения на открытом сердце в условиях искусственного кровообращения. Результаты удовлетворительные.
Принципы лечения больных в предоперационном и послеоперационном периодах
В предоперационном периоде больным рекомендуют щадящий режим и назначают симптоматическое лечение при наличии сердечной недостаточности, нарушений ритма, гипоксических приступов и так далее
При определении способа и объёма операции одновременно решают вопрос о выборе метода обезболивания (смотри полный свод знаний: Сердце, особенности обезболивания при операциях), необходимости применения искусственного кровообращения (смотри полный свод знаний) или гипотермии (смотри полный свод знаний: Гипотермия искусственная), а также кардиоплегии (смотри полный свод знаний).
В ходе операции осуществляют мониторное наблюдение (смотри полный свод знаний) венозного давления, ректальной и пищеводной температуры; контролируют динамику pH, рO2, pCO2, гематокритного числа (смотри полный свод знаний), функции почек. В конце операции для контрольных исследований оставляют тонкие поливиниловые катетеры в левом предсердии, коронарном синусе и лёгочном стволе.
После операции больных доставляют в реанимационную палату, где осуществляется непрерывное врачебное (сестринское) и мониторное наблюдение. Обращают внимание на ударный и минутный объем сердечного выброса, эффективность дыхания (искусственного или спонтанного), водно-электролитный баланс. Основная задача в этом периоде — ранняя диагностика и коррекция Всех нарушений гомеостаза (смотри полный свод знаний) для профилактики развития глубоких и необратимых изменений. Через короткие интервалы времени проводят комплекс клинических, биохимических и других исследований (гематокритного числа, электролитов крови, pH, рO2, pCO2, мочи, выделяемой жидкости из дренажей и другие); контролируют состояние свёртывающей системы крови (смотри полный свод знаний), венозного давления (смотри полный свод знаний), биохимии крови (смотри полный свод знаний), получаемой из полостей сердца через оставленные катетеры.
У больных весом более 30 килограмм, оперированных в условиях гемодилюции (смотри полный свод знаний), в реанимационном периоде проводят контроль за количеством крови и жидкости путём расчётов, учитывающих исходный вес больного, степень гемодилюции, кровопотерю (смотри полный свод знаний), количество мочи, вес больного после операции, объем крови и жидкости, выделяемых из дренажей. В соответствии со степенью потери крови и жидкости намечается компенсирующая инфузионная терапия (смотри полный свод знаний). Для переливания крови (смотри полный свод знаний) используют свежую донорскую кровь (не более 3—4-дневной давности). Катетер, введённый в мочевой пузырь (смотри полный свод знаний: Катетеризация мочевых путей) для контроля за функцией почек, удаляется как можно раньше во избежание развития цистита (смотри полный свод знаний), уретрита (смотри полный свод знаний), пиелонефрита (смотри полный свод знаний). При необходимости через зонд удаляются жидкость и воздух из желудка (смотри полный свод знаний: Зондирование желудка). Если функция желудочно-кишечные тракта не нарушена, то энтеральное питание начинают как можно раньше.
Адекватное кровообращение во многом зависит от поддержания нормальной работы сердца с помощью применения при необходимости антиаритмических средств, дефибрилляции (смотри полный свод знаний), кардиостимуляции (смотри полный свод знаний), избыточного заполнения сердца в диастоле, применения сердечных гликозидов, сосудосуживающих или сосудорасширяющих средств, кислородной терапии (смотри полный свод знаний), устранения ацидоза (смотри полный свод знаний), гиперкапнии (смотри полный свод знаний) и так далее Косвенным показателем эффективности кровообращения служат данные артериального, венозного, левопредсердного давлений, ЭКГ, периферического пульса, выделения мочи, показатели pH, рO2, pCO2 артериальной крови. Более точные сведения могут быть получены с помощью специальных методов (красочного, радиоизотопного, термодилюционного). Сердечный индекс менее чем 1,8 литров/минут указывает на низкую эффективность сердечной деятельности.
Профилактика и лечение дыхательной недостаточности в ближайшем послеоперационном периоде состоят из поддержания нормальных параметров искусственного дыхания (смотри полный свод знаний) и предупреждения лёгочных осложнений. Эффективная и стабильная сердечная деятельность, восстановление сознания, тонуса дыхательной мускулатуры являются показанием для экстубации. В случае необходимости длительной вентиляции лёгких повторную интубацию (смотри полный свод знаний) производят через 24 часа. Полную искусственную вентиляцию лёгких выполняют с помощью фармакологических препаратов, тормозящих спонтанное дыхание. Иногда перед восстановлением спонтанного дыхания полезна вспомогательная и искусственная вентиляция лёгких. Положительное аппаратное давление на выдохе помогает поддерживать достаточный дыхательный объем лёгких и предотвращает развитие ателектазов. Контроль за рO2, pCO2, pH и другими показателями наряду с клинические, признаками позволяет правильно оценить эффективность дыхания. При проведении искусственной вентиляции лёгких лучшей газовой смесью является такая, в которой O2 не превышает 60%, чтобы избежать его токсического влияния.
Санация трахеобронхиального дерева и удаление мокроты — важные факторы предотвращения обструкции и инфекции дыхательных путей. Для этого используются стерильные мягкие катетеры, вводимые в трахею и бронхи.
Лечебная физкультура (ЛФК) при Пороки сердца врождённые Как метод функциональной и восстановительной терапии ЛФК занимает одно из ведущих мест в комплексе лечебно-профилактических мероприятий и применяется главным образом в виде лечебной гимнастики.
Лечебную гимнастику начинают задолго до оперативного лечения, обучая больных правильному дыханию, тренируя сердечно-сосудистую систему дозированными нагрузками и, т. о., подготавливая больных к хирургическому лечению. Её возобновляют сразу же после операции (когда больному ещё проводят управляемую искусственную вентиляцию лёгких). Лечебная гимнастика в послеоперационном периоде способствует быстрейшему выздоровлению больных и является хорошей профилактикой различных осложнений. После выписки из стационара больному рекомендуется продолжать заниматься лечебной гимнастикой и другими формами ЛФК (дозированная ходьба, бег и другие). Главное место отводится статическим и динамическим дыхательным упражнениям. Большую роль играют также общеразвивающие упражнения с последовательным охватом различных мышечных групп (их сокращение и расслабление). Особое внимание уделяется упражнениям, корригирующим осанку и устраняющим деформацию груди, укрепляющим мышцы тела, увеличивающим подвижность позвоночника. Наиболее полезны упражнения, выполняемые свободно, без силовых напряжений. Они учащают сердечный ритм, ускоряют кровоток. Статическое напряжение используется минимально. В лечебной физкультуре применяются различные снаряды: гимнастические палки, мячи, лёгкие гантели (до 1 килограмм). Сложность упражнений постепенно увеличивают. Проводят все эти упражнения с помощью методиста; упражнения сочетают с массажем. Форма занятий может быть индивидуальной и групповой.
В процессе ЛФК необходим постоянный контроль, основанный на учёт е непосредственной реакции организма на физические нагрузки и данных, отражающих последующее их влияние в результате длительного использования этого метода. Допустимость нагрузок определяется физиологическими параметрами: частотой пульса, его лабильностью, изменениями АД, в частности пульсового давления, частотой и лабильностью дыхания, а также временем нормализации этих показателей.
Опыт показал, что под влиянием постепенно повышающихся дозированных физических нагрузок больные с врождёнными пороками сердца адаптируются к ним и заметно легче переносят оперативные вмешательства.
В соответствии с характером порока, степенью компенсации кровообращения и в зависимости от метода хирургического лечения все больные с Пороки сердца врождённые разделяются на три группы: 1) больные с удовлетворительным состоянием, не предъявляющие жалоб, с лёгкой одышкой, умеренным нарушением гемодинамики и незначительной утомляемостью после физических нагрузок; 2) больные средней тяжести, предъявляющие жалобы на слабость, быструю утомляемость, одышку, с цианозом при больших физических нагрузках, умеренными, но достаточно заметными нарушениями гемодинамики (давление в лёгочном стволе у больного с артериовенозным шунтированием может составлять 30—70% от системного давления); 3) тяжёлые больные, у которых одышка, наблюдаемая в покое, резко усиливается даже при небольших физических нагрузках, высока утомляемость, возникают тахикардия, одышечно-цианотические приступы, нередко высока лёгочная гипертензия. Для каждой группы разработаны специальные комплексы упражнений. Наиболее эффективными оказались для 1-й группы упражнения со снарядами, для 2-й — из снарядов используются только мячи. В 3-й группе проводятся общеразвивающие и дыхательные (статические и динамические) упражнения.
При проведении лечебной физкультуры в послеоперационном периоде очень важно учитывать степень травматичности и радикальности оперативного вмешательства. Рационален постепенный переход от одного двигательного режима к другому: строгий постельный (малые нагрузки), полупостельный (нагрузки расширяются), палатный (средние нагрузки), переходный и свободный режим (умеренно тренирующие нагрузки).
Активное использование ЛФК способствует уменьшению числа послеоперационных осложнений, сокращению времени пребывания больных в стационаре.
Перед выпиской больных подбирается рекомендуемая и допустимая физическая нагрузка для занятий дома.
Смотри полный свод знаний: Аорта, Сердце.
|
Зорин А.Б.; Колесов А.П. |

|
⇐ Перейти на главную страницу сайта |
⇑ Вернуться в начало страницы ⇑ |
Библиотека Ordo Deus ⇒ |
⇐ Порокератоз |
⇓ Полный свод знаний. Том первый А. ⇓ |
Пороки сердца приобретённые ⇒ |
|
Все статьи в полном изложении, Вы можете найти в большой медицинской энциклопедии — Главный редактор: академик АН СССР (РАН) и АМН СССР (РАМН) Б.В. Петровский. — Москва издательство «Советская энциклопедия» 1989г. |
|
Внимание! Вы находитесь в библиотеке «Ordo Deus». Все книги в электронном варианте, содержащиеся в библиотеке «Ordo Deus», принадлежат их законным владельцам (авторам, переводчикам, издательствам). Все книги и статьи взяты из открытых источников и размещаются здесь только для чтения. |
|
Вся информация на сайте Ordo Deus находится в свободном доступе. Ordo Deus не предоставляет информацию на платной основе. |
|
Все авторские права сохраняются за правообладателями. Если Вы являетесь автором данного документа и хотите дополнить его или изменить, уточнить реквизиты автора, опубликовать другие документы или возможно вы не желаете, чтобы какой-то из ваших материалов находился в библиотеке, пожалуйста, свяжитесь с нами по e-mail: |
Вас категорически не устраивает перспектива безвозвратно исчезнуть из этого мира? Вы не желаете закончить свой жизненный путь в виде омерзительной гниющей органической массы пожираемой копошащимися в ней могильными червями? Вы желаете вернувшись в молодость прожить ещё одну жизнь? Начать всё заново? Исправить совершённые ошибки? Осуществить несбывшиеся мечты? Перейдите по ссылке: «главная страница».
|
© Ordo Deus, 2010. При копировании ссылка на сайт http://www.ordodeus.ru обязательна. |