Искусственное кровообращение |
||
 |
 |
Оглавление
|
Искусственное кровообращениеИскусственное кровообращение (синоним: экстракорпоральное кровообращение, искусственная перфузия) — способ поддержания кровотока в организме, отдельном органе или отдельной области искусственным путем. Впервые мысль о возможности «сохранить в живом состоянии любую часть человеческого организма» с помощью искусственного кровообращения высказал французский физиолог Легаллуа (С. J. J. Legallois, 1812). В дальнейшем многие физиологи пытались осуществить эту идею в эксперименте на изолированных органах животных или человека. Ш. Броун-Секару (1858) впервые удалось восстановить признаки жизни отсеченной от туловища головы собаки при пропускании через ее сосуды артериальной крови с помощью шприца. Мартин и Гопкинс (Н. Martin, J. Hopkins, 1881), Фредерик (L. A. Fredericq, 1890), Э. Старлинг (1898) и другие осуществляли перфузию отдельных органов с помощью перекрестного кровообращения или изолированного сердечно-легочного препарата. Различные варианты искусственного кровообращения обычно предусматривают одновременно искусственную оксигенацию поступающей из организма в аппарат и возвращаемой в него крови. Искусственное кровообращение может быть осуществлено как с помощью сердца и легких другого организма, так и с помощью специальных механических устройств — аппаратов искусственного кровообращения (АИК). Первый примитивный аппарат для искусственного кровообращения, включавший механические устройства для оксигенации и нагнетания крови, был создан Фреем и Грубером (М. Frey, M. Gruber, 1885). Самым крупным вкладом в развитие искусственного кровообращения были фундаментальные исследования С. С. Брюхоненко и его последователей С. И. Чечулина, Н. Н. Тереванского и В. Д. Янковского. Эти исследования, начатые в начале 20-х гг. 20 в., явились основополагающими в решении проблем искусственного кровообращения, связанных с конструированием аппарата «сердце — легкие», разработкой способов стабилизации. Свертывающей системы крови, а также использованием искусственного кровообращения для целей оживления целого организма и кардиохирургии. Созданный С. С. Брюхоненко и С. И. Чечулиным прибор, названный ими «автожектор», и его дальнейшие модификации фактически были первыми аппаратами, пригодными для осуществления полного искусственного кровообращения в эксперименте на животных. Они послужили прототипом целой серии отечественных аппаратов искусственного кровообращения, нашедших в дальнейшем широкое применение в клинике. Первые операции на открытом сердце с применением искусственного кровообращения в эксперименте осуществлены Н. Н. Теребинским в 1930 г., а в клинике — в 1953 гг. Гиббоном (J. H. Gibbon). В СССР пионерами освоения метода искусственного кровообращения в клинике были коллективы, руководимые Н. М. Амосовым, А. А. Вишневским, А. Н. Бакулевым, С. А. Колесниковым, П. А. Куприяновым, Б. В. Петровским и другими. Первая успешная операция с искусственным кровообращением в СССР выполнена А. А. Вишневским в 1957 г. Практическое применение в клинике нашли три основных метода искусственного кровообращения: общее искусственное кровообращение, регионарное искусственное кровообращение и различные варианты вспомогательного кровообращения. Общее искусственное кровообращение — наиболее распространенный метод. Он предусматривает полную замену насосной функции сердца и газообменной функции легких механическими устройствами на непродолжительное время. Основной аспект его применения — кардиохирургия. Регионарное искусственное кровообращение — перфузия отдельного органа или области организма, временно изолированной от остальной сосудистой системы. Применяется главным образом в онкологии и гнойной хирургии для подведения больших концентраций лекарственных веществ непосредственно к очагу поражения. Один из вариантов регионарного искусственного кровообращения — коронарно-каротидная перфузия — используется некоторыми авторами для целей кардиохирургии. В сочетании с умеренной гипотермией (смотри Гипотермия искусственная) он позволяет выполнять операции на сердце длительностью до 30 минут. Искусственное кровообращение для целей кардиохирургии получило широкое распространение. Во многих клиниках мира практически все операции на сердце выполняются в условиях искусственного кровообращения. |
Аппараты искусственного кровообращения
Искусственное кровообращение осуществляется с помощью перфузионного аппарата (АИК).
К современному АИК для общего искусственного кровообращения предъявляют следующие основные требования: 1) аппарат должен надежно поддерживать на протяжении всей перфузии заданный минутный объем кровообращения в организме (порядка 4—5 л для взрослого больного) и заданную температуру циркулирующей крови; 2) оксигенатор должен обеспечивать адекватную артериализацию крови: насыщение ее кислородом не ниже чем до 95% и поддержание рСО2 на уровне 35—45 мм ртутного столба; объем заполнения АИК должен быть небольшим (не более 3 л при перфузии взрослых больных); аппарат должен быть снабжен устройством для возврата в циркуляторный контур крови, изливающейся из вскрытых полостей сердца и поврежденных тканей; 5) травма крови в аппарате должна быть минимальной (не более 40 мг% свободного гемоглобина плазмы за первый час перфузии); 6) физиологически блок АИК должен изготовляться из нетоксичного материала, химически инертного по отношению к крови; его конструкция должна обеспечивать возможность очистки и стерилизации в условиях клиники.
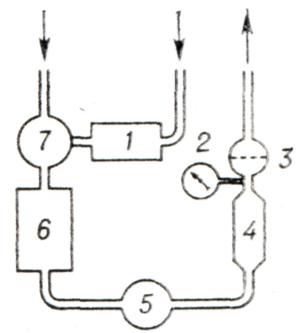
Любой АИК состоит из двух блоков: физиологического и механического. К физиологическому блоку относятся все детали, соприкасающиеся с кровью. Основными узлами физиологического блока являются оксигенатор, или «искусственное легкое», и артериальный насос, или «искусственное сердце». Сюда же относятся различного рода емкости и шланги, с помощью которых узлы физиологического блока соединяются между собой, образуя экстракорпоральную систему — так называемый циркуляторный контур аппарата, по которому движется кровь во время искусственного кровообращения. На рисунке 1 представлена типичная схема АИК используемого в кардиохирургии для общего искусственного кровообращения.
 |
 |
 |
Рис. 1. | ||
Венозная кровь из сосудов больного самотеком переливается в оксигенатор, располагающийся ниже уровня операционного стола, где насыщается кислородом, освобождается от избытка углекислоты и далее артериальным насосом нагнетается в кровяное русло больного.
Перед тем как попасть в кровяное русло больного кровь проходит через теплообменник (устройство для поддержания необходимой температуры крови) и фильтр-ловушку, предохраняющий от попадания в сосудистое русло больного эмболов (тромботические массы, кусочки кальция с клапанов и пузырьки газа). Кровь из вскрытых полостей сердца и поврежденных тканей эвакуируется в АИК с помощью специального устройства — так называемого коронарного отсоса.
Оксигенаторы
Оксигенаторы делятся на два основных класса: оксигенаторы, в которых газообмен осуществляется при непосредственном контакте кислорода с кровью, и оксигенаторы, где кровь и кислород разделены газопроницаемой мембраной.
В первый класс входят два типа: пузырьковые и пленочные. Второй класс получил название мембранных оксигенаторов.
Большая площадь контакта кислорода с кровью в пузырьковых оксигенаторах достигается путем подачи газообразного кислорода непосредственно в кровь.
Газообмен кислорода с кровью в пленочных оксигенаторах достигается благодаря созданию тонкой пленки крови на какой-либо твердой основе, помещенной в атмосферу кислорода. В мембранных оксигенаторах газообмен между кровью и кислородом осуществляется через газопроницаемую мембрану.
Насосы.
Конструкция и изготовление устройств, выполняющих нагнетательную функцию сердца, встречают меньше трудностей, чем решение проблемы искусственной артериализации крови. Создаются насосы, обладающие производительностью, приблизительно равной минутному объему сердца в покое, то есть порядка 5 л⁄мин, однако при их конструировании учитываются специфические требования, предъявляемые к «искусственному сердцу».
Практическое применение в АИК нашли два основных класса насосов: клапанные и бесклапанные.
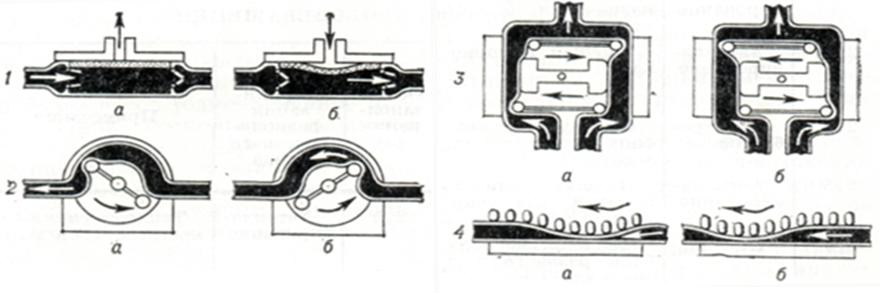
Клапанные насосы подразделяются на насосы с внутренними и наружными клапанами. Наиболее типичными представителями клапанных насосов являются мембранные и камерные насосы (рис. 2, 1 и 2).
Бесклапанные насосы работают по принципу выдавливания крови из эластичной трубки путем прокатывания по ней ролика или попеременного пережатия ее механическими «пальцами» (роликовые и пальчиковые насосы, рис. 2, 3 и 4). При конструировании насосов для АИК учитывают реологические свойства крови (вязкость, скорость тока крови по магистралям аппарата и другое), чтобы свести к минимуму травматизацию ее клеток.
 |
 |
 |
Рис. 4. | ||
Дополнительные узлы.
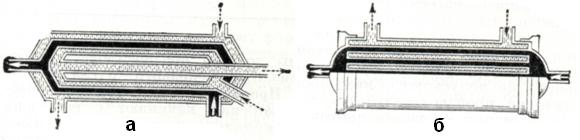
Дополнительными узлами физиологического блока АИК являются теплообменник и система коронарного отсоса. Первый необходим для поддержания нужной температуры крови, а следовательно, и температуры тела больного в ходе искусственного кровообращения в АИК нашли применение два вида теплообменников: трубчатый и щелевой, конструкция которых приведена на рисунке 3. Охлаждение или подогревание крови достигается за счет изменения температуры воды, омывающей теплообменник.
Система коронарного отсоса возвращает кровь в циркуляторный контур аппарата. В зависимости от конструкции АИК это осуществляется с помощью либо вакуум-отсоса, либо одного или нескольких роликовых насосов.
К вспомогательным узлам физиологического блока относятся различного рода сосуды для резервной и удаленной отсосом крови, фильтры-ловушки для пузырьков воздуха и тому подобное.
К механическому блоку АИК относится корпус аппарата с приводами насосов и подвижных частей оксигенатора, а также измерительная аппаратура для определения производительности насосов, расхода газов, температуры крови и тому подобное. В качестве источника энергии используется электричество или сжатый газ. Обязательным элементом механического блока является аварийный ручной привод.
Все аппараты искусственного кровообращения, используемые в клинике, представляют комбинацию различных элементов АИК (табл.; рис. 4 и 5). Аппараты для регионарной перфузии отличаются от аппаратов для общей перфузии взрослого человека меньшими габаритами и производительностью (до 1 —1,5 л⁄мин). В них отсутствует устройство для отсасывания крови.
 |
 |
 |
 |
 |
 |
Рис. 5. | ||
Особый вид аппаратуры в комплекте АИК-5М и ИСЛ-4 — аппарат для коронарной перфузии. Он предназначен для защиты миокарда от гипоксии во время открытых операций на клапанах аорты, когда естественный кровоток по сосудам сердца прекращается. Аппарат для коронарной перфузии состоит из двух насосов небольшой производительности (до 500 мл⁄мин), позволяющих проводить раздельную перфузию обеих коронарных артерий с объемной скоростною и под давлением, соответствующими таковым в естественных условиях. Аппарат для коронарной перфузии не имеет собственного оксигенатора и является приставкой к аппарату для общей перфузии.
Общей тенденцией в дальнейшем совершенствовании аппаратов является все более широкое применение в них физиологического блока одноразового пользования, микропористых фильтров в артериальной линии и переход к мембранным оксигенаторам.
Характеристика некоторых аппаратов искусственного кровообращения дана в таблице.
Методика и техника искусственного кровообращения
Показания к искусственному кровообращению постоянно расширяются в связи с совершенствованием аппаратуры и методики перфузии. В крупных кардиохирургических центрах АИК используют при всех внутрисердечных операциях, реконструктивных операциях на коронарных сосудах и многих других оперативных вмешательствах на крупных магистральных сосудах.
Подготовка АИК.
Необходимое условие использования перфузионной аппаратуры — абсолютная чистота ее поверхностей, соприкасающихся с кровью. Это достигается обработкой всех элементов физиологического блока детергентами или концентрированными растворами щелочей с последующим промыванием водой. Лишь после этого аппарат собирают и стерилизуют.
В зависимости от материала, из которого изготовляются отдельные элементы физиологического блока, используют либо автоклавирование, либо холодный способ стерилизации с помощью бактерицидного газа (окись этилена) или раствора (диоцид, бета-пропиолактон). Широкое распространение получили готовые к употреблению стерильные апирогенные перфузионные системы однократного пользования.
Полностью собранный АИК заполняют кровью или кровезаменителем и на определенном этапе операции подсоединяют к больному.
Подключение АИК.
Схема и техника подключения АИК могут быть различными в зависимости от операционного доступа и вида патологии сердца (или сосуда). Для нагнетания крови чаще используют одну из бедренных или подвздошных артерий, откуда ретроградно кровь поступает в брюшную и грудную аорту, затем в ее дугу, проходя в сосуды, питающие мозг и сердце (коронарные сосуды). Иногда артериализированную кровь нагнетают через канюлю в восходящий отдел аорты. Дренирование венозной системы производят либо с помощью двух пластмассовых катетеров, введенных в обе полые вены через правое предсердие либо с помощью одного катетера, введенного в правое предсердие или желудочек. Венозная кровь поступает в оксигенатор АИК, где насыщается кислородом, и насосом АИК направляется в артериальную систему больного. Обе эти манипуляции производят после введения в кровь больного гепарина в дозе 2—3 мг на 1 кг веса тела. Для большей безопасности больного канюлирование артериальной системы должно предшествовать катетеризации венозного русла.
Проведение искусственного кровообращения
Проведение искусственного кровообращения начинают с включения артериального насоса на малую производительность и одновременного снятия зажимов с венозной линии аппарата. Однако при этом полного оттока крови из организма больного не допускают. Синхронно увеличивая производительность насоса и величину венозного притока, в течение 1—2 минут доводят объемную скорость перфузии до расчетной, которая должна составлять 2,2—2,4 л⁄мин на 1 м2 поверхности тела.
В дальнейшем величину объемной скорости и режим работы оксигенатора поддерживают, руководствуясь критериями адекватности перфузии. В качестве таковых, помимо общепринятых в клинической, анестезиологии показателей (АД, венозное давление), определяют насыщение кислородом или рО2 артериальной и венозной крови, на основании кото-рых могут быть вычислены общее потребление кислорода, процент его утилизации и так далее и показатели кислотно-щелочного состояния (рН, pCО2, SB, BE и другие).
Длительность искусственного кровеобращения зависит от характера патологии и колеблется от нескольких минут (ушивание дефекта межпредсердной перегородки, ликвидация изолированного клапанного стеноза легочного ствола) до 3 и более часов (одновременное протезирование нескольких клапанов сердца). Всегда следует стремиться к минимальным срокам перфузии и ограничивать ее применение только теми этапами операции, которые не могут быть выполнены без искусственного кровеобращения.
Переход на естественное кровообращение начинают с постепенного или одномоментного прекращения поступления крови в аппарат с одновременным уменьшением производительности артериального насоса.
Нагнетание крови в артерии полностью прекращают по достижении оптимального объема циркулирующей крови в сосудистом русле больного, о чем судят по величине центрального венозного давления, которая должна составлять в этот момент 150 —180 мм водного столба.
В случае длительного искусственного кровеобращения (свыше 1 часа) целесообразно сочетать его с общим охлаждением организма (смотри Гипотермия искусственная) за счет подачи в теплообменник холодной воды (так называемая гипотермическая перфузия). Гипотермия сопровождается снижением потребности организма в кислороде, что дает возможность уменьшить объемную скорость перфузии, а тем самым и травму форменных элементов крови. Степень охлаждения может быть различной и определяется условиями операции. В большинстве случаев достаточна умеренная гипотермия (температура в пищеводе не ниже 28°). Глубокая гипотермия до 15—10° применяется крайне редко, в случае необходимости временной полной остановки кровообращения (коррекция редких аномалий развития сердца, устранение неполадок в перфузионной аппаратуре).
При проведении искусственного кровеобращения широко применяют метод так называемой управляемой гемодилюции, то есть разбавление циркулирующей крови провезамещающими жидкостями. В качестве последних используют различные низкомолекулярные растворы электролитов, Сахаров или белков. Это, помимо уменьшения количества донорской крови, существенно улучшает тканевой кровоток за счет повышения реологических свойств крови и снижает травматизацию эритроцитов. Степень применяемой гемодилюции зависит от кислородной емкости крови больного (содержания гемоглобина) и его индивидуальных особенностей. Зона оптимального реологического эффекта разведения, по данным А. Н. Филатова, Ф. В. Баллюзека (1972), находится в диапазоне 20—30%.
Патологическая физиология
Искусственное кровеобращение ставит организм больного в необычные, филогенетически беспрецедентные условия. Такие «ненормальности» в организме, как ретроградный ток крови в аорте, резкое снижение давления в полостях сердца или их полное запустевание, выключение малого круга из кровообращения, наличие в крови продуктов разрушения ее форменных элементов и тканей, вызывают патологические, реакции организма на перфузию.
Во время операции с искусственным кровеобращением наблюдается состояние, приближающееся к такому, которое возникает при массивном повреждении тканей в сочетании с большой кровопотерей, то есть к геморрагическому шоку. Обезболивание не в состоянии сделать организм полностью нечувствительным к воздействиям искусственного кровообращения, особенно его гуморальному компоненту.
Наиболее характерны изменения гемодинамики. Так как минутный объем кровообращения во время перфузии поддерживается работой артериального насоса, эти изменения обусловлены главным образом сдвигами в системе сосудов.
Для искусственного кровеобращения характерно снижение общего периферического сопротивления и АД. При этом сопротивление в различных участках сосудистой системы меняется поразному, обусловливая перераспределение кровотока в организме; при этом наблюдаются две тенденции: так называемое защитное перераспределение и централизация кровообращения.
Защитное перераспределение заключается в относительном увеличении кровотока во внутренних жизненно важных органах за счет уменьшения его в поверхностных органах и тканях. Этот феномен выражен тем больше, чем ниже объемная скорость перфузии. В обычных условиях такая реакция сосудов характерна для геморрагического шока, при котором она носит действительно защитный характер. В условиях искусственного кровеобращения она мешает достижению оптимального кровотока в периферических тканях даже при высокой объемной скорости перфузии. Централизация кровообращения заключается в снижении тканевого кровотока на фоне относительно неизменного и даже увеличенного кровотока в крупных сосудах. Ухудшению тканевого кровотока во время искусственного кровеобращения способствует также повышенная склонность эритроцитов к внутрисосудистой агрегации.
Гипотермическая перфузия двояко влияет на гемодинамику. С одной стороны, холодовое торможение вазомоторного центра, вызывая общую вазодилатацию, препятствует развитию феномена «защитного» перераспределения кровотока. В то же время снижение температуры крови увеличивает ее вязкость и склонность эритроцитов к агрегации. Это ведет к ухудшению микроциркуляции и дальнейшей централизации кровообращения.
Непосредственным следствием описанных гемодинамических изменений являются нередко наблюдаемые во время искусственного кровеобращения гипоксия тканей и признаки метаболического ацидоза в крови. Патогенетическая профилактика этих нежелательных явлений должна быть направлена прежде всего на улучшение микроциркуляции, устранение феноменов «защитного» перераспределения и централизации кровообращения. Наиболее действенные меры в этом отношении — управляемая гемодилюция и искусственная гипотония. Для этой цели применяют ганглиоблокаторы (арфонад, гигроний), которые обладают мощным децентрализующим влиянием на кровообращение и полностью устраняют феномен «защитного» перераспределения кровотока. Искусственное кровеобращение, проводимое на фоне искусственной вазоплегии, реже сопровождается гипоксией тканей и метаболическим ацидозом.
Осложнения
Эмболия сосудов
Эмболия сосудов головного мозга, коронарных сосудов и сосудов других жизненно важных органов может быть вызвана газом, тромботическими массами, частицами кальция, каплями жира и другого. Профилактика подобных осложнений сводится к комплексу последовательных мероприятий, направленных на удаление воздуха и различных частиц из камер сердца и заполнение их кровью, которые проводятся перед включением сердца в кровообращение. Для профилактики воздушной эмболии в этот период большое значение имеет тактика перфузиолога, управляющего работой системы, дренирующей левые камеры сердца. Уменьшение ее производительности и полное выключение могут быть предприняты только по указанию хирурга или анестезиолога. В качестве универсальной меры профилактики воздушной эмболии многие хирурги применяют подачу углекислого газа в операционную рану перед герметизацией полостей сердца. Углекислый газ хорошо растворяется в жидкостях и быстрее, чем воздух, покидает просвет сосуда.
Попадание пузырьков кислорода из оксигенатора в артериальную линию аппарата — вторая возможная причина газовой эмболии. В связи с совершенствованием перфузионной аппаратуры и повышением ее надежности это осложнение встречается редко.
Для предупреждения эмболии применяют микропористые артериальные фильтры однократного пользования. Эти фильтры устанавливаются в артериальной линии АИК. Они способны задержать частицы размером до 40 мкм.
Эмболия сосудов головного мозга может иметь различные симптомы (от незначительных неврологических знаков до глубокой мозговой комы) и нередко заканчивается смертью больного. Терапия этого осложнения должна быть направлена прежде всего на профилактику и лечение отека мозга (см. Отек и набухание головного мозга).
Одним из самых эффективных лечебных мероприятий при газовой эмболии является немедленное помещение больного в камеру с повышенным барометрическим давлением.
Гипоксия
Гипоксия жизненно важных органов может быть следствием двух основных причин: недостаточной производительности оксигенатора или артериального насоса и нарушением микроциркуляции. Клинисеским, признаком гипоксии является нарастание метаболического ацидоза в ходе перфузии. Последствия гипоксии бывают различными и зависят от ее степени и длительности.
При современной технике искусственного кровеобращения это осложнение грозит смертельным исходом лишь при резком отклонении перфузии от ее нормального течения. Причинами могут быть выход из строя иерфузионной аппаратуры и слишком большое шунтирование нагнетаемой в кровеносное русло больного крови через пораженный аортальный клапан или бронхиальные анастомозы. Резкое снижение кровотока в организме может привести в этом случае к необратимым изменениям в жизненно важных органах. Профилактикой постгипоксического отека мозга во время искусственного кровеобращения. является немедленное охлаждение нагнетаемой крови с помощью теплообменника. В случае необходимости гипотермию мозга целесообразно продолжать и в постперфузиониом периоде.
Гематологические осложнения
Гематологические осложнения могут быть вызваны групповой или белковой несовместимостью крови донора и больного, реакцией больного на массивную гемотрансфузию цитратной крови, повышенной травмой крови в аппарате, нарушением свертывания крови и водно-электролитного баланса. Клинические, проявления этих осложнений различны. Реакция больного на чужеродную кровь проявляется целым комплексом симптомов, часто объединяемых под названием «синдром гомологичной крови».
Профилактика осложнений, связанных с введением в организм консервированной крови, должна быть направлена прежде всего на уменьшение ее количества. Решающую роль здесь играют применение аппаратов с малым объемом заполнения и использование гемодилюции. Степень травматизации крови зависит от ряда факторов: длительности и способа сохранения донорской крови, совершенства перфузионной аппаратуры и методики ее применения, продолжительности перфузии. Современные аппараты искусственного кровеобращения сравнительно мало травмируют кровь, и величина гемолиза при работе с ними обычно не превышает 30—40 мг% свободного гемоглобина плазмы при перфузии длительностью до 1 часа, что, как правило, хорошо переносится больными. Наметить границы предельно допустимого гемолиза невозможно, так как толерантность к нему сильно варьирует у разных групп больных. Она зависит от исходного состояния его паренхиматозных органов — почек, печени. Различные клин, сихмптомы нарушения функции этих органов чаще наблюдаются у больных с приобретенными пороками сердца, сопровождающимися нарушением кровообращения. Решающими условиями для уменьшения степени гемолиза являются гемодилюция и экономное использование коронарного отсоса — основного источника гемолиза.
Нарушение свертывания крови после операции с искусственным кровеобращением наблюдается нередко. Наиболее частыми причинами его могут быть неадекватная нейтрализация гепарина протамина сульфатом, дефибринация плазмы и разрушение тромбоцитов в АИК. Эффективными мерами борьбы с этим осложнением являются введение дополнительных доз протамина сульфата под контролем повторного титрования крови больного, переливание фибриногена и тромбоцитной массы.
Более редким, но опасным осложнением операций с искусственным кровеобращением является фибринолиз. Основными причинами его возникновения являются массивная гемотрансфузия на фоне искусственного кровеобращения. К возникновению фибринолиза более предрасположены больные с приобретенными пороками сердца, сопровождающимися функциональными нарушениями паренхиматозных органов. Мерами предупреждения фибринолиза являются профилактическое введение в кровь до или во время искусственного кровеобращения эпсилон-амино-капроновой кислоты, отказ от переливания больших количеств консервированной крови за счет гемодилюции, своевременная коррекция метаболического ацидоза. Наилучшие результаты лечения развившегося фибринолиза дает применение больших доз трасилола. Эффективной мерой борьбы с любой формой нарушения свертывания крови является переливание цельной донорской крови.
Общая анестезия
Общая анестезия при применении искусственного кровообращения имеет целый ряд специфических особенностей. Искусственное кровеобращение вызывает в организме ряд патофизиологических нарушений, что наряду с хирургическим вмешательством (пережатие аорты, прекращение коронарного кровотока, фибрилляция желудочков сердца, рассечение и сшивание мышцы сердца, замена клапанов, коррекция внутрисердечных дефектов и так далее) требует согласованной работы хирурга и специалистов других профилей, обеспечивающих безопасность операции.
Премедикация.
Для предупреждения отрицательных эмоциональных реакций и нарушений гомеостаза и компенсаторных механизмов организма премедикация у больных с заболеваниями сердца должна быть многокомпонентной (транквилизаторы, антигистаминные препараты, анальгетические и ваголитическиа средства). По существу премедикация при операциях на сердце в условиях искусственного кровеобращения не отличается от таковой при других операциях на сердце.
Вводный наркоз.
Существуют различные способы введения в наркозбольных с заболеваниями сердцаи крупных сосудов. При этом важно соблюдать следующие основные принципы: а) сохранение оптимальных параметров внешнего дыхания и гемодинамики в период введения анестетика и релаксанта; б) использование минимальных доз анестетиков и оптимальных доз релаксантов; в) проведение интубации на фоне адекватного расслабления мышц и гипервентиляции кислородом; г) быстрое налаживание искусственной вентиляции легких с подачей основного анестетика; д) постоянный контроль за сердечной деятельностью и сосудистым тонусом.
Для непосредственного введения больного в наркоз с одинаковым успехом могут быть использованы барбитураты ультракороткого действия в 1% растворе, препараты для нейролептаналгезии (дроперидол и фентанил), атаралгезии (седуксен + анальгетик) в соответствующих дозах в расчете на 1 кг веса больного. Можно применять также ингаляционные анестетики (фторотан, закись азота, циклопропан). У маленьких детей целесообразно внутримышечно (в палате) ввести кетамин (5 мг⁄кг).
Период поддержания наркоза.
Специфика операций с искусственным кровообращением диктует необходимость выделения трех периодов основного наркоза: 1) предперфузионный; 2) перфузионный; 3) постперфузионный.
Предперфузионный период.
В этом периоде целесообразно выделить три этапа: 1) до вскрытия перикарда; 2) манипуляции на сердце и магистральных сосудах; 3) от момента введения венозных канюль до начала перфузии.
Первый этап — наркоз не отличается от такового при операциях на органах грудной полости.
Второй этап — могут наблюдаться нарушения гемодинамики вследствие ряда причин: перерастяжения ранорасширителем краев раны грудной стенки и уменьшения притока крови к сердцу, смещения сердца при пальцевом обследовании, различных нарушений ритма сердца во время этих манипуляций, нарушения кровотока при выделении полых вен и другого.
Нарушения ритма сердечной деятельности, приводящие к снижению АД, требуют временного прекращения манипуляций на сердце и сосудах и принятия необходимых мер для улучшения работы сердца, а при отсутствии эффекта от кардиальной терапии — вспомогательного массажа сердца и экстренного подключения АИК.
Третий этап — наиболее ответственный. С введением катетеров в полые вены существенно уменьшается приток крови к сердцу и возникают явления застоя в венозной системе. Особенно опасен застой в системе верхней полой вены, результатом которого может быть возникновение отека головного мозга.
Для предупреждения этого осложнения необходимо соблюдать следующую последовательность подключения АИК: артериальная магистраль, нижняя полая вена, верхняя полая вена.
В этот период целесообразно перейти на ручную искусственную вентиляцию легких, создавая при необходимости положительное давление как на вдохе, так и на выдохе, в период заполнения катетеров и так далее
Для поддержания наркоза в предперфузионном периоде применяют закись азота с кислородом в сочетании с препаратами для нейролептаналгезии фторотаном (0,5%) или метоксифлураном (0,3—0,5%). Из миорелаксантов отдают предпочтение препаратам недеполяризирующего типа действия (тубокурарин) в обычных дозировках.
Перфузионный период.
Особенность этого периода заключается в том, что наркотическое состояние и релаксацию приходится поддерживать путем введения соответствующих препаратов непосредственно в оксигенатор АИК. В связи с тем что легкие больного не участвуют в газообмене, их раздувают закисью азота с кислородом (4:1) под давлением 10—12 см водного столба во избежание развития ателектазов.
Постперфузионный период.
В задачи анестезиолога входит поддержание адекватной гемодинамики, которая после коррекции порока и отключения АИК нормализуется не сразу. В целях поддержания гемодинамики вводятся новодрин, глюкагон, гидрокортизон, строфантин, хлорид кальция и другие. Искусственную вентиляцию легких проводят до полного восстановления самостоятельного дыхания, при необходимости в течение нескольких дней.
Пролонгированная вентиляция легких позволяет на оптимальном уровне стабилизировать газообмен и на этом фоне корригировать другие нарушения. В частности, легче поддаются регуляции гемодинамика, кислотно-щелочное состояние, нормализуется температура. Последнее происходит без дрожи и, следовательно, без увеличения потребления кислорода, столь нежелательного в непосредственном послеоперационном периоде, когда механизмы компенсации нередко находятся на грани срыва. Параллельно мероприятиям по поддержанию гемодинамики анестезиологу приходится восстанавливать нормальную свертываемость крови, нейтрализуя гепарин протамина сульфатом и вводя при ацидозе бикарбонат натрия или трисамин.
Особое внимание анестезиолог должен уделять адекватному возмещению кровопотери и нормализации объема циркулирующей крови.
|
Бунятян А.А., Осипов В.П. |

|
|
Все статьи в полном изложении, Вы можете найти в большой медицинской энциклопедии — Главный редактор: академик АН СССР (РАН) и АМН СССР (РАМН) Б.В. Петровский. — Москва издательство «Советская энциклопедия» 1989г. |
|
Внимание! Вы находитесь в библиотеке «Ordo Deus». Все книги в электронном варианте, содержащиеся в библиотеке «Ordo Deus», принадлежат их законным владельцам (авторам, переводчикам, издательствам). Все книги и статьи взяты из открытых источников и размещаются здесь только для чтения. |
|
Библиотека «Ordo Deus» не преследует никакой коммерческой выгоды. |
|
Все авторские права сохраняются за правообладателями. Если Вы являетесь автором данного документа и хотите дополнить его или изменить, уточнить реквизиты автора, опубликовать другие документы или возможно вы не желаете, чтобы какой-то из ваших материалов находился в библиотеке, пожалуйста, свяжитесь с нами по e-mail: |
Вас категорически не устраивает перспектива безвозвратно исчезнуть из этого мира? Вы желаете прожить ещё одну жизнь? Начать всё заново? Исправить ошибки этой жизни? Осуществить несбывшиеся мечты? Перейдите по ссылке: «главная страница».
|
© Ordo Deus, 2010. При копировании ссылка на сайт http://www.ordodeus.ru обязательна. |