Гемолитическая анемия |
||
 |
 |
Оглавление
|
Гемолитическая анемияГемолитическая анемия (anaemia haemolytica; греческий haima кровь + lysis разрушение, растворение; анемия) — групповое название заболеваний, общим признаком которых является усиленное разрушение эритроцитов, обусловливающее, с одной стороны, анемию и повышенное образование продуктов распада эритроцитов, с другой — реактивно усиленный эритроцитопоэз. Увеличение продуктов распада эритроцитов клинически проявляется желтухой (смотри) лимонного оттенка, повышением содержания в крови непрямого (неконъюгированного) билирубина (смотри Гипербилирубинемия) и сывороточного железа, плейохромией желчи и кала, уробилинурией (смотри). При внутрисосудистом гемолизе (смотри) добавочно возникают гипергемоглобинемия (смотри Гемоглобинемия), гемоглобинурия (смотри), гемосидеринурия. Об усилении эритропоэза свидетельствуют ретикулоцитоз и полихроматофилия в периферической крови, эритронормобластоз костного мозга. КлассификацияДеление Гемолитическая анемия на острые и хронические оказалось неприемлемым, так как острые и хронический варианты могут наблюдаться в пределах одних и тех же форм Гемолитическая анемия. Не оправдано и противопоставление Гемолитическая анемия с внутриклеточной и внутрисосудистой локализацией гемолиза, поскольку при одной и той же форме Гемолитическая анемия может иметь место внутриклеточный и внутрисосудистый гемолиз. Не лишено условности разделение Гемолитическая анемия на обусловленные эндо- и экзоэритроцитарными гемолитическими факторами; например, при пароксизмальной ночной гемоглобинурии основной дефект локализуется в мембране эритроцитов, а гемолитический фактор (комплемент) локализуется вне эритроцита. Наиболее оправдано разделение гемолитических анемий на две основные группы — наследственные (врождённые) и приобретённые Гемолитическая анемия Наследственные Гемолитическая анемия могут быть обусловлены патологией либо мембраны эритроцитов, либо структуры или синтеза гемоглобина, а также дефицитом одного из энзимов эритроцитов. Наследственные Гемолитическая анемия объединены по генетическому принципу, но существенно различаются по этиологии, патогенезу и клинической картине. К приобретённым Гемолитическая анемия относят большую группу иммуногемолитических анемий, группу приобретённых мембранопатий и другие. Предложена следующая классификация Гемолитическая анемия (Ю. И. Лорие, 1967; Л. И. Идельсон, 1975): I. Наследственные (врождённые) Мембранопатии эритроцитов: а) микросфероцитарная; б) овалоцитарная; в) акантоцитарная. Энзимопенические (ферментопенические): а) связанные с дефицитом ферментов пентозо-фосфатного цикла; б) связанные с дефицитом ферментов гликолиза; в) связанные с дефицитом ферментов, участвующих в образовании, окислении и восстановлении глутатиона; г) связанные с дефицитом ферментов, участвующих в использовании АТФ; д) связанные с дефицитом ферментов, участвующих в синтезе порфиринов. Гемоглобинопатии: а) гемоглобинопатии качественные; б) талассемия. II. Приобретённые Иммуногемолитические анемии: а) аутоиммунные; б) изоиммунные. Приобретённые мембранопатии: а) пароксизмальная ночная гемоглобинурия; б) шпороклеточная анемия. Связанные с механическим повреждением эритроцитов: а) маршевая гемоглобинурия; б) болезнь Мошкович (синонимы микроангиопатическая Гемолитическая анемия); в) возникающие при протезировании клапанов сердца. Токсические. Наследственные гемолитические анемии |
Мембранопатии эритроцитов
Мембранопатии связаны с аномалиями белковых или липидных компонентов оболочки эритроцитов, что является причиной изменения их формы и преждевременного их разрушения. Ранее к мембранопатиям относили и так называемый врождённые несфероцитарные Гемолитическая анемия, которые позднее в связи с выявлением при них дефицита ферментов гликолиза были отнесены к энзимопеническим анемиям.
Микросфероцитарная гемолитическая анемия (синонимы: врождённый микросфероцитоз, болезнь Минковского — Шоффара, микроцитемия, сфероцитарная анемия) впервые описана Ванлером и Мазиусом (С. Vanlair, Masius, 1871) под названием микроцитемия, но как самостоятельная болезнь стала известна после классических работ О. Минковского (1900) и Шоффара (А. М. Chauffard, 1907).
Статистика не разработана. Болезнь описана во всех частях света; в Европе встречается чаще, чем в Америке. В связи с широким применением спленэктомии больным с микросфероцитарной Гемолитическая анемия, которая, как правило, ведёт к клинической, выздоровлению, возможно учащение этого заболевания, так как увеличиваются шансы передачи его по наследству (больные доживают до детородного возраста).
Этиология неизвестна. Сущность дефекта в мембране эритроцитов окончательно не установлена. Заболевание наследуется по аутосомно-доминантному типу.
Патогенез. Ведущее значение в развитии Гемолитическая анемия придают пониженному содержанию в мембране эритроцитов актомиозиноподобного белка и частичному лишению мембраны фосфолипидов и холестерина, что обусловливает уменьшение общей поверхности эритроцитов, снижение ее индекса и способствует превращению эритроцитов в микросфероциты. Вторичную роль приписывают повышению проницаемости мембраны для ионов натрия, усиливающих активность аденозинтрифосфатазы и повышающих интенсивность процессов гликолиза. В условиях замедленного селезёночного кровотока с низким pH и содержанием глюкозы «старение» эритроцитов ускоряется. Кроме того, микросфероциты, утратившие пластичность нормальных эритроцитов, чисто механически задерживаются при прохождении из пульпы селезёнки в венозные синусоиды перед узкими (диаметром до 3,5 микрометров) порами между эндотелиальными клетками, выстилающими их поверхность. Этим объясняется прекращение усиленного гемолиза после спленэктомии, несмотря на сохранение эритроцитами микросфероцитарной формы.
Клиническая картина
Несмотря на врождённый характер микросфероцитарной Гемолитическая анемия, первые её проявления обычно отмечают в старшем детском и юношеском возрасте, хотя описаны случаи заболевания и у грудных детей, и у стариков. Течение болезни отличается большим разнообразием — от субклинического до тяжёлого, с частыми гемолитическими кризами. Жалобы могут отсутствовать (по выражению Шоффара, «больные больше желты, чем больны») либо они обусловлены анемической гипоксией, приступами желчнокаменной колики. Основной симптом — желтуха кожи, склер и слизистых оболочек различной и непостоянной интенсивности. Желтуха сопровождается выделением интенсивно окрашенного кала и темной мочи. Селезёнка увеличена постоянно, печень — у половины больных. У некоторых больных могут встречаться врождённые аномалии: башенный череп, готическое небо, бради- или полидактилия, шейные ребра, косоглазие, пороки развития сердца и сосудов и другие (так называемый гемолитическая конституция). При развитии болезни в раннем детском возрасте на рентгенограмме черепа отмечается расширение диплоических пространств. Анемия обычно умеренна, иногда отсутствует вследствие компенсации нерезкого гемолиза усиленным эритропоэзом. Даже при длительном и интенсивном гемолизе эритропоэз остаётся активным. Тяжёлые гемолитические кризы возникают чаще у женщин. Они развиваются постепенно, в течение 7— 10 дней, и провоцируются обычно инфекциями, родами. Иногда анемия усугубляется внезапным развитием так называемый апластических (арегенераторных) кризов, которые характеризуются исчезновением ретикулоцитов из крови и эритронормобластов из костного мозга, резким уменьшением желтухи и других признаков гемолиза. У части больных кризы сопровождаются лейко- и тромбоцитопенией. Обычно апластические кризы длятся 7—10 дней, иногда затягиваясь до 2 месяцев.
У части больных на коже голеней образуются двусторонние язвы в области внутренних мыщелков; они заживают только после спленэктомии. В механизме их возникновения не исключается возможность микротромбозов сфероцитами. При исследовании крови выявляют микросфероцитоз (сфероцитоз) эритроцитов: средний диаметр эритроцитов снижен до 6 микрометров и менее, толщина их увеличена до 2,5—3 микрометров, средний объем эритроцитов и соответственно среднее содержание гемоглобина в эритроците обычно нормальны или несколько увеличены. Микросфероциты могут быть обнаружены при обычном просмотре окрашенного мазка крови — они имеют вид мелких интенсивно окрашенных клеток без центрального просветления. Объективно микросфероциты определяются путем эритроцитометрии (смотри): вершина кривой Прайс-Джонса смещается влево (в сторону микроцитов), основание кривой в связи с анизоцитозом уширяется. Содержание ретикулоцитов стойко повышено (до 20% и более). В пунктате костного мозга обнаруживается выраженная гиперплазия эритробластического ростка с повышенным числом митозов и признаками ускоренного созревания. Осмотическая стойкость микросфероцитов резко снижена: гемолиз может начинаться при концентрации хлорида натрия, близкой к физиологической (0,70— 0,75%). Механическая стойкость микросфероцитов в 4—8 раз ниже, чем нормальных эритроцитов. Кислотная эритрограмма (смотри) отличается резким сдвигом основного максимума вправо, увеличением общей продолжительности гемолиза. После отмывания эритроцитов от плазмы основной максимум кислотной эритрограммы смещается влево, длительность гемолиза сокращается; это позволяет допустить наличие в плазме вещества, ингибирующего гемолиз микросфероцитов. При стёртых формах микросфероцитарной Гемолитическая анемия осмотическую стойкость эритроцитов следует определять с их предварительной суточной инкубацией при t° 37° (она снижается в значительно большей степени, чем у эритроцитов здоровых лиц). Аналогично исследуют кислотную эритрограмму отмытых эритроцитов больных после инкубации при t° 37°. В течение 48 часов спонтанный гемолиз (аутогемолиз) составляет в среднем 50%, тогда как у здоровых лиц — не более 5% . Продолжительность жизни микросфероцитов в кровеносном русле значительно снижается. В то же время сроки циркуляции нормальных эритроцитов в кровеносном русле больных, а также сроки циркуляции микросфероцитов, переливаемых реципиентам, ранее подвергнутым спленэктомии, остаются нормальными. Это подтверждает отсутствие плазменных факторов гемолиза при микросфероцитарной Гемолитическая анемия. Об этом же свидетельствуют и результаты серологические исследования: прямая проба Кумбса (смотри Кумбса реакция) всегда отрицательна, непрямая положительна у больных, сенсибилизированных в результате беременности резус-несовместимым плодом или гемотрансфузий. Содержание свободного гемоглобина в плазме нормальное. Гемоглобин всегда относится к «взрослому» типу (А); лишь у грудных детей с микросфероцитарной Гемолитическая анемия обнаруживают соответствующее возрасту содержание гемоглобина F. Уровень билирубина сыворотки всегда повышен, преимущественно за счёт непрямой (неконъюгированной) фракции. Выраженность билирубинемии не всегда соответствует интенсивности гемолиза — при хорошей билирубин выделительной функции печени она может оставаться незначительной. Значительно повышается суточное выделение уробилиногена с калом и уробилина с мочой.
Осложнения. Примерно у 30—40% больных, чаще при интенсивном и длительном гемолизе, образуются пигментные камни в желчевыделительных путях, обусловливающие приступы желчнокаменной колики. Обтурация общего желчного протока вызывает механическую желтуху.
Диагноз основывается на установлении желтухи гемолитического типа, микросфероцитоза и сниженной осмотической, механической резистентности эритроцитов, характерной кислотной эритрограммы. Наличие микросфероцитоза, сниженной осмотической стойкости эритроцитов, отрицательной прямой пробы Кумбса и нормального уровня свободного гемоглобина плазмы позволяет дифференцировать микросфероцитарную Гемолитическая анемия от других Гемолитическая анемия, а также от функциональных гипербилирубинемий.
JIечение
Единственным методом, обеспечивающим прекращение гемолиза и практическое выздоровление больных, является спленэктомия (смотри). Считают, что при спокойном течении болезни от операции можно воздержаться. Однако поскольку почти у всех больных рано или поздно развиваются осложнения, правильнее оперировать всех больных после установления диагноза, за исключением, может быть, детей раннего возраста, стариков и больных с тяжёлой сердечно-сосудистой патологией. Операция допустима и при беременности (лучше делать в сочетании с кесаревым сечением). Рецидивы болезни после спленэктомии наблюдаются только при наличии добавочных селезёнок, не замеченных при операции. Все признаки гипергемолиза после операции быстро стихают и обычно через 3—4 недель состав крови полностью нормализуется. Микросфероцитоз и снижение осмотической стойкости эритроцитов после операции сохраняются пожизненно, однако выраженность их несколько уменьшается. Осложнения и летальный исход после спленэктомии наблюдаются редко. Все консервативные мероприятия при Гемолитическая анемия неэффективны. Переливание крови эритроцитной массы) следует применять с заместительной целью только при глубокой анемии (гемолитические и апластические кризы). Повторные гемотрансфузии нежелательны в связи с опасностью изосенсибилизации. После спленэктомии надобность в гемотрансфузиях отпадает.
Прогноз после спленэктомии благоприятный, при отказе от операции — сомнительный ввиду возможности развития указанных осложнений. Трудоспособность больных до лечения зависит от тяжести анемии и степени компенсации анемической гипоксии. Больные должны быть информированы о вероятности передачи заболевания по наследству (но и об излечимости заболевания). Летальность невысокая.
Профилактика не разработана. Единственным методом предупреждения осложнений является ранняя спленэктомия.
Овалоцитарная гемолитическая анемия (синонимы эллиптоцитарная Гемолитическая анемия). Впервые наличие в крови людей эритроцитов овальной формы описал Дресбах (М. Dresbach, 1904). В крови здоровых лиц содержится до 8— 15% овалоцитов (физиологический овалоцитоз). Больший процент овалоцитов, так называемый овалоцитоз, обнаруживают в 0,02—0,05% случаев, а в 10—12% из них наблюдается овалоцитарная Гемолитическая анемия
Этиология неизвестна. Заболевание наследуется по аутосомно-доминантному типу, передаётся, по видимому, двумя генами, один из которых сцеплен с генами системы резус. Экспрессивность генов варьирует в широких пределах.
Патогенез обусловлен дефектом мембраны эритроцитов. Единственным местом разрушения эритроцитов является селезёнка, но секвестрация не связана с аномалией их формы (овалоциты носителей не задерживаются в селезёнке и имеют нормальный срок циркуляции).
Клиническая картина, осложнения, лечение, прогноз — как при микросфероцитарной Гемолитическая анемия.
Диагноз ставится на основании преобладания в периферической крови эритроцитов овальной формы с учётом симптоматики Гемолитическая анемия Средний объем эритроцитов, концентрация и содержание гемоглобина в эритроцитах нормальны. В пунктате костного мозга клетки красного ряда приобретают овальную форму на стадии полихроматофильных нормобластов. Осмотическая резистентность эритроцитов обычно нормальная, при инкубации их не резко снижается. Тест аутогемолиза не усилен. Продолжительность жизни эритроцитов укорочена, при носительстве овалоцитов — нормальна. Серологические реакции, показатели пигментного обмена — как при микросфероцитарной Гемолитическая анемия
Акантоцитарная гемолитическая анемия получила название по форме эритроцитов — акантоциты (греческий akantha шип, колючка) имеют на поверхности 5—10 длинных узких шипообразных выростов. Содержание фосфолипидов и холестерина в мембране эритроцитов нормальное, но имеются сдвиги во фракциях фосфолипидов — повышение сфингомиелина и снижение фосфатидилхолина.
Этиология. Акантоцитарная Гемолитическая анемия — редкое заболевание раннего детского возраста, связанное с врожденным отсутствием (β-липопротеинов (смотри Абеталипопротеинемия). Наследуется по аутосомно-рецессивному типу.
Патогенез. Образование акантоцитов и их фосфолипидную аномалию связывают с нахождением эритроцитов в патологический плазме — в молодых эритроцитах морфологически и биохимический изменения минимальны. В плазме отсутствуют В-протеин (белковый компонент β-липопротеинов), триглицериды; уровень холестерина обычно ниже 50 миллиграмм/100 миллилитров, фосфолипидов — ниже 100 миллиграмм/100 миллилитров.
Клиническая картина характеризуется сочетанием умеренной Гемолитическая анемия и стеатореи (смотри) с избирательным нарушением всасывания жиров. Характерна картина крови: эритроциты имеют длинные узкие шипообразные выросты, продолжительность жизни их укорочена, обнаруживается ретикулоцитоз. Осмотическая стойкость эритроцитов нормальная, аутогемолиз после инкубации при t° 4° и 37° резко усилен, корригируется добавлением витамина Е [Брейн (М. С. Brain), 1971]. В плазме отсутствуют В-протеин и триглицериды, уменьшено содержание холестерина и фосфолипидов.
Осложнения. Пигментный ретинит (с исходом в слепоту) и атактическая нейропатия.
Диагноз ставится на основании характерной клин, картины, обнаружения акантоцитарной формы эритроцитов, ретикулоцитоза, укорочения продолжительности жизни эритроцитов.
Лечение не разработано. Назначение витамина Е не эффективно.
Прогноз в отношении жизни неблагоприятный.
Энзимопенические анемии
Гемолитическая анемия развиваются вследствие дефицита различных ферментов эритроцитов. В соответствии с недостаточностью определённых ферментных систем выделяют несколько групп энзимопатий: Гемолитическая анемия, связанные с дефицитом ферментов пентозо-фосфатного цикла (дефицит глюкозо-6-фосфат-дегидрогеназы, дефицит 6-фосфоглюконат-дегидрогеназы); Гемолитическая анемия, связанные с дефицитом ферментов гликолиза (дефицит пируваткиназы, триозофосфатизомеразы, 2,3-дифосфоглицератмутазы и другие); Гемолитическая анемия, связанные с дефицитом ферментов, участвующих в образовании, окислении и восстановлении глютатиона (дефицит синтетазы, редуктазы и пероксидазы); Гемолитическая анемия, связанные с дефицитом аденозинтрифосфатазы, аденилаткиназы, рибофосфат-пирофосфаткиназы, то есть ферментов, участвующих в использовании АТФ; Гемолитическая анемия, связанные с дефицитом ферментов, участвующих в синтезе порфиринов. Это эритропоэтическая уропорфирия и эритропоэтическая протопорфирия (смотри Энзимопеническая анемия).
Гемоглобинопатии
Гемолитическая анемия, связанные с нарушением структуры или синтеза гемоглобина. Различают гемоглобинопатии, обусловленные аномалией первичной структуры гемоглобина, или качественные, например, серповидноклеточная анемия (смотри), и вызванные нарушением синтеза цепей гемоглобина, или количественные — талассемии (смотри), при некоторых из них в эритроцитах обнаруживают гемоглобин Н, гемоглобин Bart и другие.
Приобретённые гемолитические анемии
Иммуногемолитические анемии
Иммуногемолитические анемии характеризуются наличием в крови антител против антигенов собственных или перелитых (донорских) эритроцитов.
Аутоиммунные гемолитические анемии могут быть обусловлены наличием тепловых аутоантител, холодовых агглютининов, двухфазных гемолизинов, а также аутоантител, появляющихся при приёме некоторых лекарственных средств.
Аутоиммуногемолитические анемии, вызываемые тепловыми аутоантителами (синонимы: приобретённая Гемолитическая анемия, приобретённая гемолитическая желтуха типа Гайема — Видаля, иммуногемолитическая анемия), имеют две формы: идиопатическую и симптоматическую (развивающуюся чаще на фоне опухолей лимфоидной ткани и больших коллагенозов, например, при системной красной волчанке).
На долю этой формы приходится около 25% всех Гемолитическая анемия Болеют лица любого возраста, женщины немного чаще, чем мужчины. Соотношение идиопатической и симптоматической форм 1 : 1.
Этиология неизвестна. О приобретённом характере заболевания свидетельствует отсутствие семейных случаев. У части больных развитие заболевания связывают с приёмом метилдопа.
Патогенез: существуют две теории образования аутоантител: 1) первичное изменение мембраны эритроцитов с образованием нового или обнажением скрытого (глубинного) антигена и последующей реакцией иммунологический системы; 2) первичное изменение клеток (соматическая мутация) иммунологический системы с образованием антител к нормальным антигенам эритроцитов. Тепловые аутоантитела по серологические свойствам чаще всего принадлежат к неполным агглютининам; на основании иммунохимических исследований (с помощью моноспецифических антиглобулиновых сывороток) их относят к иммуноглобулину G (IgG), иногда одновременно обнаруживают иммуноглобулины М и A (IgM и IgA). Гемолиз эритроцитов с фиксированными на них антителами происходит путём их фрагментации или эритрофагоцитоза. Разрушение эритроцитов совершается в селезёнке, в костном мозге, лимф, узлах и печени. У части больных эритроциты разрушаются непосредственно в кровеносном русле; у этой части больных обнаруживают и полные гемолизины.
Клиническая картина: начало болезни чаще постепенное, но может быть и острым, с картиной бурного гемолиза и анемической комой (так называемый острая Гемолитическая анемия Ледерера). Течение обычно хроническое, с периодами обострений. Жалобы больных обусловлены в основном анемической гипоксией. Кожа бледная, желтушная, иногда отчётливо выражен акроцианоз. Желтуха может быть различной интенсивности, сопровождается плейохромией кала, уробилинурией. В сыворотке повышено содержание непрямого билирубина; при быстро прогрессирующем гемолизе, сопровождающемся анемическими некрозами печени, повышается и конъюгированная фракция билирубина. Селезёнка увеличена незначительно или умеренно; при симптоматической форме возможна резкая спленомегалия (за счёт основного заболевания). Печень увеличена примерно у 1/3 больных. При исследовании крови обнаруживают нормо- или гиперхромную анемию, высокий ретикулоцитоз, иногда нормобласты, резкий анизоцитоз эритроцитов, наличие микросфероцитов и макроцитов; встречаются фрагменты эритроцитов, эритрофагоцитирующие моноциты. Часто наблюдается аутоагглютинация эритроцитов. Средний объем эритроцитов обычно увеличен, их осмотическая резистентность снижена, после инкубации эритроцитов она снижается ещё более (но меньше, чем при микросфероцитарной Гемолитическая анемия). После инкубации эритроцитов усилен и их аутогемолиз. Свободный гемоглобин плазмы нередко повышен, особенно при наличии в крови гемолизинов и на высоте гемолитических кризов. При значительной и длительной гемоглобинемии снижается уровень гаптоглобина плазмы, возможно появление гемоглобина и гемосидерина в моче. Продолжительность жизни эритроцитов как собственных, так и перелитых от донора, укорочена, нередко значительно. Число лейкоцитов нормальное или снижено при хронический течении, но при обострениях болезни может наблюдаться значительный нейтрофильный лейкоцитоз со сдвигом влево. При симптоматических аутоиммунных Гемолитическая анемия лейкоцитарная формула определяется основным заболеванием. Число тромбоцитов нормальное или снижено, иногда резко. В миелограмме отмечают выраженную эритронормобластическую реакцию. Эритропоэз макронормобластический, нередко с наличием мегалобластов, что связывают с усиленным потреблением эндогенного витамина В12 и фолиевой кислоты. Выраженная тромбоцитопения может вести к развитию тяжёлой кровоточивости (синдром Фишера — Эванса), иногда одновременно с лейкопенией (иммунная панцитопения).
Осложнения: апластические кризы, тромбозы, ведущие к инфарктам соответствующих органов; образование камней в желчных путях отмечается редко.
Диагноз стал возможным после введения диагностической пробы Кумбса. Он основан на установлении приобретённой Гемолитическая анемия с внутриклеточной или смешанной локализацией гемолиза и подтверждается положительной прямой пробой Кумбса, интенсивность которой различна, но может соответствовать тяжести гемолиза. Иногда прямая проба бывает отрицательной или становится положительной в относительно поздние сроки болезни. Положительная непрямая проба Кумбса (выявляющая свободные антитела в плазме) не патогномонична для аутоиммунных Гемолитическая анемия, она обычно обусловлена наличием изоантител (после трансфузий, при беременности).
Лечение: обычно назначают кортикостероидные гормоны. Начальная доза преднизолона должна быть не менее 1 миллиграмм на 1 килограмм веса в сутки внутрь; при тяжёлом течении и глубокой анемии дозу повышают до 2— 3 миллиграмм на 1 килограмм веса, половину её вводят парентерально. При улучшении дозу препарата постепенно снижают, но настолько, чтобы обеспечивать нарастание гемоглобина. После нормализации показателей красной крови
гормоны продолжают вводить малыми дозами (15—20 миллиграмм преднизолона в день); при состоянии гематологические ремиссии их вводят ещё в течение 2—3 месяцев и лишь затем постепенно отменяют. Одновременно с гормонами назначают соли калия, щелочи. Механизм лечебный действия гормонов при аутоиммунной Гемолитическая анемия неясен. Предполагают тормозящее действие на иммунокомпетентные клетки, однако скорость терапевтического эффекта (иногда уже через 24—48 часов) свидетельствует о прямом влиянии на процесс кроверазрушения. Гормонотерапия обеспечивает клин, выздоровление примерно 75% больных. Прямая проба Кумбса остаётся положительной в течение ряда месяцев и лет. Отрицательный эффект гормонотерапии можно объяснить либо невозможностью применения достаточных доз гормонов вследствие развития диабета, гипертонии и так далее, либо устойчивостью к кортикостероидам. В этих случаях показана спленэктомия; она даёт эффект примерно у половины оперированных больных, но не исключает поздние рецидивы гемолиза. При неудаче кортикостероидной терапии применяют также иммунодепрессанты (6-меркаптопурин, азатиоприн, циклофосфан и другие). Имеются сообщения об успешном применении тимэктомии у детей. Трансфузии крови (эритроцитной массы) показаны только при тяжёлой прогрессирующей анемии. При анемической коме одномоментно переливают до 750—1000 миллилитров крови (донора подбирают по непрямой пробе Кумбса).
Прогноз чаще сомнительный, хотя не исключается возможность длительного спокойного течения и даже спонтанного выздоровления. Трудоспособность больных до лечения стойко снижена. Прогностически неблагоприятными симптомами считают наличие выраженной тромбоцитопении, положительной непрямой пробы Кумбса, гемолизинов в сыворотке. Непосредственными причинами летального исхода могут явиться неудержимый гемолиз, тромбоцитопенические кровотечения, тромбозы.
Гемолитические анемии, вызываемые Холодовыми аутоантителами. Различают идиопатическую и симптоматическую формы. Симптоматическая чаще развивается на фоне некоторых лимфопролиферативных процессов, инфекционного мононуклеоза, микоплазменной (атипичной) пневмонии; возможна в любом возрасте. Идиопатическая форма заболевания встречается редко, чаще у женщин и у лиц пожилого возраста.
Этиология неизвестна. Механизм образования холодовых агглютининов под влиянием инфекционных возбудителей не установлен.
Патогенез: холодовые аутоантитела фиксируются вместе с комплементом на эритроцитах в мелких сосудах дистальных участков тела (при охлаждении их до температуры ниже 32°).
Явный гемолиз возникает при титре антител 1 : 1000. Холодовые агглютинины обладают серологические специфичностью к антигенам I или i (последнее чаще при симптоматической форме). Иммунохимических методами исследования их идентифицируют как иммуноглобулины М (IgM), реже обнаруживают сочетание иммуноглобулинов М и G (IgM + IgG), за гемолитическую активность ответственны Х-цепи. Разрушение агглютинированных эритроцитов происходит как в сосудистом русле, так и в результате эритрофагоцитоза в селезёнке, печени и костном мозге (смешанная локализация гемолиза). Агглютинаты в мелких сосудах нарушают кровообращение в них, обусловливая клинику синдрома Рейно (смотри Рейно болезнь).
Клиническая картина: основными клинической, проявлениями болезни являются обычно умеренно выраженная Гемолитическая анемия и возникающие при охлаждении нарушения периферического кровообращения по типу синдрома Рейно. Наблюдается акроцианоз, редко акрогангрены. Желтуха обычно не интенсивна. Размеры печени и селезёнки нормальные или несколько увеличены. Течение болезни обычно хронический, непрогрессирующее. Возможны тяжёлые гемоглобинурийные кризы. Симптоматическая форма возникает остро и заканчивается спонтанным выздоровлением. При исследовании крови обнаруживают умеренную анемию. Эритроциты морфологически мало изменены, иногда небольшой сфероцитоз, эритрофагоцитоз, при охлаждении эритроциты быстро агглютинируют; после подогревания пробы крови агглютинаты эритроцитов исчезают. Осмотическая резистентность эритроцитов нормальна или несколько снижена. Ретикулоцитоз умеренный. Число лейкоцитов и тромбоцитов нормально или снижено. РОЭ может быть резко ускоренной. В плазме повышен непрямой билирубин и свободный гемоглобин (после охлаждения); в моче может обнаруживаться гемоглобин и гемосидерин.
Осложнения могут быть обусловлены нарушением кровотока в мелких сосудах (например, развитие гангрены пальцев рук и ног).
Диагноз основан на выявлении Гемолитическая анемия, синдрома Рейно и обнаружении Холодовых агглютининов в достаточно высоком титре (1 : 1 000 000). Прямая проба Кумбса (для исследования кровь берут в посуду, согретую до t° 37°) с цельной антиглобулиновой сывороткой всегда положительна, из моноспецифических сывороток положительна только с анти-С.
Лечение: кортикостероиды и спленэктомия малоэффективны. Описан благоприятный эффект от лейкерана. При глубокой анемии показаны трансфузии эритроцитов, отмытых от плазмы (для устранения комплемента).
Прогноз в отношении выздоровления сомнительный. Трудоспособность может сохраняться.
Гемолитическая анемия, вызванная двухфазными гемолизинами (пароксизмальная холодовая гемоглобинурия), — редкое заболевание, которое составляет 4,6% всех иммуногемолитических анемий.
Этиология. Заболевание развивается при острых вирусных инфекциях, реже при сифилисе.
Патогенез. Пароксизмальная холодовая гемоглобинурия возникает при наличии в крови двухфазных гемолизинов Доната — Ландштейнера, которые при охлаждении организма оседают на эритроцитах и осуществляют гемолиз при t° 37°. Двухфазные гемолизины обладают электрофоретической подвижностью, соответствующей γ-фракции; они относятся к иммуноглобулинам G (IgG).
Клиническая картина характеризуется симптомами тяжёлого общего состояния, одышкой, лихорадкой, головной болью, болью в мышцах и суставах, а также признаками бурного внутрисосудистого гемолиза (появление чёрной мочи, желтуха, анемия). Нередко наблюдается неукротимая рвота желчью, жидкий стул. Селезёнка и печень умеренно увеличены, чувствительны. Лёгкая форма пароксизмальной Холодовой гемоглобинурии протекает с субфебрильной температурой и кратковременной гемоглобинурией. При исследовании крови выявляют резкую нормохромную анемию, базофильную пунктацию эритроцитов, полихромазию эритроцитов, нормобласты, увеличенное количество ретикулоцитов, а также нейтрофильный лейкоцитоз со сдвигом влево, иногда до промиелоцитов и даже миелобластов. Обнаруживают гипербилирубинемию (за счёт неконъюгированного билирубина), увеличение гемоглобина до 30— 40 миллиграмм/ 100 миллилитров. Сыворотка крови окрашена в розовый цвет, при стоянии она становится коричневой за счёт образования метгемоглобина. В пунктате костного мозга— картина реактивного эритропоэза, эритрофагоцитоз. При других исследованиях выявляют гемоглобинурию (смотри), плейохромию желчи, повышенное выделение стеркобилина с калом.
Осложнения: почечная недостаточность, анурия.
Лечение: проводят противошоковые мероприятия (сердечно-сосудистые средства, морфин, адреналин, кортин, кислород), переливание одногруппной крови (250—500 миллилитров), полиглюкина (500—1000 миллилитров), назначают щелочи внутрь и внутривенно (5% свежеприготовленный раствор бикарбоната натрия капельно в общей дозе 500—1000 миллилитров). С целью быстрейшего очищения плазмы от гемоглобина вводят осмотические диуретики — 30% раствор свежеприготовленного стерильного лиофилизированного препарата мочевины на 10% растворе глюкозы в общей дозе 200—300 миллилитров. Показаны глюкокортикоиды.
Прогноз определяется массивностью гемолиза, состоянием функции почек, своевременностью и эффективностью лечения. При благоприятном исходе в течение 2—4 недель наступает полное клин, выздоровление. Прогноз неблагоприятен в случаях, осложнённых анурией и почечной недостаточностью. При молниеносной форме возможен летальный исход от шока и острой аноксии в течение первых двух суток.
Лекарственная иммуногемолитическая анемия возникает при медикаментозных гемолитических реакциях, осуществляющихся при участии антител.
Этиология и патогенез. Аутоантитела могут появляться при приёме некоторых лекарственных препаратов (пенициллин, стрептомицин, ПАСК, индометацин, пирамидон, фенацетин, хинин, хинидин и другие). Механизм участия медикаментов в развитии Гемолитическая анемия может быть различным. При гаптенном механизме развития Гемолитическая анемия препарат вступает в соединение с компонентом поверхности эритроцитов и вызывает образование антилекарственных антител типа IgG, при повторном приёме препарата антитела фиксируются на эритроцитах, блокированных им. Таков механизм действия пенициллина; при этом обычной аллергической реакции к пенициллину может и не наблюдаться. При образовании иммунных комплексов препарат соединяется с белком-носителем и стимулирует образование антител типа IgM. Комплекс препарат — антитело повреждает мембрану эритроцитов, способствует фиксации на них комплемента, вызывая гемолиз. Таков механизм действия хинина и хинидина. Но медикамент может индуцировать образование истинных аутоантител, таких как при тепловой аутоиммунной Гемолитическая анемия. Таков механизм действия α-метилдопа (допегит). Причинным фактором может быть также мебедрол (мефенамин), хлордиазепоксид (элениум). После отмены препарата все антитела быстро исчезают.
Клиническая картина определяется тяжестью и локализацией гемолиза. Преобладают формы лёгкие и средней тяжести. Заболевание протекает остро, со смешанной локализацией гемолиза. В сыворотке обнаруживают антитела, агглютинирующие эритроциты больного и здоровых лиц (в присутствии данного препарата).
Диагноз основывается на анамнестических данных, положительной прямой пробе Кумбса с моноспецифическими сыворотками.
Лечение сводится в основном к отмене препарата, вызвавшего Гемолитическая анемия Кортикостероиды эффективны только при Гемолитическая анемия, вызванной а-метилдопа, но должны применяться осторожно из-за опасности нарастания АД. При тяжёлой анемии показаны гемотрансфузии.
Изоиммунные гемолитические анемии могут развиваться у новорожденных с несовместимостью систем АВ0 и резус плода и матери (смотри Гемолитическая болезнь новорожденных), а также как осложнение при переливаниях крови, тоже несовместимой по системам АВ0, резус и его редким разновидностям. Это посттрансфузионные гемолитические анемии (смотри Переливание крови). При изоиммунных Гемолитическая анемия антитела обнаруживаются в сыворотке при постановке непрямой реакции Кумбса.
Приобретённые мембранопатии
Пароксизмальная ночная гемоглобинурия (синонимы: болезнь Штрюбинга — Маркиафавы, болезнь Маркиафавы — Микели) рассматривается как приобретённая эритроцитопатия (семейно-наследственные формы заболевания не выявлены); возникает вследствие соматической мутации, ведущей к появлению аномальной популяции эритроцитов. Доказано моноклоновое происхождение этой популяции эритроцитов. Гемолиз эритроцитов вызывается только комплементом, но провоцируется самыми различными, в том числе физиологический, факторами (состоянием сна, у женщин — месячными); появление гемоглобинурии связано со сдвигами кислотно-щелочного равновесия в сторону ацидоза при вышеуказанных состояниях. Провоцирующими агентами могут быть также интеркуррентные инфекции, состояния гиперкоагуляции крови, медикаменты, переливание крови как цельной (особенно свежей), так и плазмы. Пароксизмальная ночная гемоглобинурия может начинаться картиной гипопластического состояния кроветворения; в ряде случаев характерная картина заболевания развёртывается через 10—12 и более лет после обнаружения гипоплазии кроветворения, иногда после спленэктомии.
Клиническая картина
Заболевание отличается длительным течением. На фоне гемоглобинемии и гемосидеринурии возникают пароксизмы гемоглобинурии, чаще ночные.
При исследовании крови выявляют выраженную анемию гипохромного типа, умеренное уменьшение количества гранулоцитов и тромбоцитов. Вследствие длительной гемосидеринурии («железный диабет») истощаются депо железа в организме и развивается гипосидеремия. Отмечаются симптомы гемолитической желтухи: гипербилирубинемия (за счёт неконъюгированной фракции), уробилинурия, плейохромия желчи, ретикулоцитоз. Печень и селезёнка чаще не увеличены. Костный мозг гиперплазирован за счёт элементов эритропоэза.
Осложнения. В период гемоглобинурийных кризов болезнь нередко осложняется синдромом гиперкоагуляции с последующими сосудистыми тромбозами в системе воротной вены, абдоминальных, мозговых, коронарных сосудах, у женщин, кроме того, и в сосудах малого таза, что сопровождается болями в зоне тромбозов. Наклонность к сосудистым тромбозам связана с поступлением в кровь тромбопластических субстанций из распавшихся эритроцитов. Тромбозы иногда осложняются инфарктами в различных органах; в частности тромбозы в системе воротной вены ведут к инфарктам селезёнки с развитием тромбофлебитической спленомегалии и портальной гипертензии. В редких случаях наблюдается переход пароксизмальной ночной гемоглобинурии в гиперпластический, миелопролиферативный синдром — эритромиелоз или острый миелобластный лейкоз.
Диагноз ставится с помощью специфических лабораторных тестов (кислотная и сахарозная пробы), а также на основании клин, картины непрерывного внутрисосудистого гемолиза, сопровождающегося чаще пароксизмами ночной гемоглобинурии. Кислотная проба, или проба Хэма, основана на определении чувствительности эритроцитов к комплементу свежей человеческой сыворотки, подкисленной добавлением 0,2% раствора соляной кислоты до pH 6,5. Проба считается положительной, если гемолизуется больше 5% (иногда до 50—80%) эритроцитов. Сахарозная проба, или проба Хартманна — Дженкинса, основана на том, что эритроциты больных лизируются в слабом растворе сахарозы в присутствии комплемента. Проба считается положительной, когда лизису подвергаются более 4% исследуемых эритроцитов.
Лечение сводится к поддержанию на оптимальном уровне показателей красной крови путём систематических переливаний отмытых 3—5 раз (физиологический раствором) эритроцитов или эритроцитов 7—10-дневной давности (срок инактивации комплемента). Переливание свежей цельной крови и плазмы противопоказано, т. к. это усиливает гемолиз. При гипосидеремии показаны препараты железа в малых, индивидуально толерантных дозах, в сочетании с анаболическими гормонами (неробол, ретаболил). При тромботических осложнениях назначают гепарин, иногда в сочетании с фибринолизином. Глюкокортикоиды (преднизолон) в развёрнутой стадии заболевания противопоказаны. В гипопластической фазе болезни показан весь арсенал средств, применяемых при гипопластической анемии,— глюкокортикоиды, андрогены, гемотрансфузии и допустимо переливание не отмытых свежих эритроцитов. При упорных тромбоцитопенических кровотечениях показана спленэктомия.
Прогноз серьёзный. Летальный исход может наступить в начальной стадии вследствие анемической комы на фоне тромбоцитопенических кровотечений, в развёрнутой гемолитической стадии — в результате сосудисто-тромботических или септических осложнений, в редких случаях от острого лейкоза.
Шпороклеточная гемолитическая анемия описана Смитом (J. A. Smith) с сотрудники (1964) у больных с тяжёлыми формами цирроза печени.
Этиология неизвестна.
Патогенез заболевания связан с избыточным содержанием холестерина и недостаточностью фосфолипидов в мембране эритроцитов.
Клиническая картина, лечение и прогноз как при микросфероцитарной Гемолитическая анемия
Диагноз основывается на обнаружении в крови эритроцитов с многочисленными мелкими отростками.
Гемолитические анемии, обусловленные механическим повреждением эритроцитов
Маршевая пароксизмальная гемоглобинурия описана впервые Флейшером (R. Fleischer, 1881), который наблюдал её у здорового солдата, совершившего длительный пеший переход.
Этиология и патогенез. Гемолиз эритроцитов развивается у физически крепких молодых людей в связи с повышенной нагрузкой на мышцы нижних конечностей при длительной ходьбе, марше, беге, лыжном переходе, а также на мышцы рук при проведении приёмов карате. По данным Дейвидсона (R. J. L. Davidson, 1964), маршевая гемоглобинурия возникает при беге по твёрдой поверхности (после бега по мягкой поверхности или в обуви с эластическими стельками гемоглобинурия у тех же лиц не развивается). Предрасполагающим фактором является гипогаптоглобинемия. В сосудах частей тела, длительно испытывающих столкновение с жёсткой поверхностью (стопы ног, кисти рук), местно развивается механический гемолиз.
Клиническая картина характеризуется мягким течением болезни, отсутствием лихорадки и обусловлена интенсивностью внутрисосудистого гемолиза. Возможны тяжёлые гемоглобинурийные кризы, чаще отмечается умеренная гемоглобинемия и гемоглобинурия, снижение гаптоглобина в сыворотке. Исходное состояние больных нормальное. Морфологически аномалий эритроцитов не отмечают.
Дифференциальный диагноз с другими гемоглобинуриями основан на данных анамнеза (связь заболевания с механическим фактором, а не с охлаждением или приёмом лекарств) и результатах эритроцитарных проб (сахарозная и кислотная). От маршевой миоглобинурии (смотри) отличает отсутствие мышечных болей, обнаружение в моче гемоглобина.
Лечение обычно не требуется.
Профилактика заключается в изменении условий физ. нагрузок: иногда достаточно сменить обувь на более эластичную и изменить технику бега, чтобы полностью устранить гемолиз эритроцитов.
Прогноз благоприятный.
Болезнь Мошкович (синонимы микроангиопатическая Гемолитическая анемия) — групповое понятие, обозначающее Гемолитическая анемия при некоторых патологический состояниях, обусловленных поражением мелких сосудов (артериол) в сочетании с диссеминированным внутрисосудистым свёртыванием (смотри Мошкович болезнь).
Гемолитические анемии, возникающие при протезировании клапанов сердца. При протезировании клапанов сердца возможно развитие Гемолитическая анемия, что обусловлено механической травматизацией и разрывом мембраны (фрагментацией) исходно полноценных эритроцитов больного. Чаще развивается при недостаточности искусственных клапанов левого сердца вследствие форсированного пассажа крови при систоле желудочка через зазоры между протезом и клапанным кольцом.
Клиническая картина проявляется интенсивностью внутрисосудистого гемолиза, который более выражен при активном поведении больного, чем при выполнении им строгого постельного режима. При исследовании крови обнаруживают анемию, иногда гипохромию эритроцитов, ретикулоцитоз, гемоглобинемию, снижение или отсутствие гаптоглобина в плазме. Характерно наличие морфологически признаков фрагментации эритроцитов (шистоциты, треугольные и шлемовидные эритроциты). Описаны случаи с положительной прямой пробой Кумбса. В моче обнаруживают гемоглобин и гемосидерин.
Диагноз основан на данных анамнеза, исследования крови (признаки внутрисосудистого гемолиза и фрагментации эритроцитов) и мочи (наличие гемоглобина и гемосидерина).
Лечение. При глубокой стойкой анемии показана операция с реконструкцией протеза. В лёгких случаях ограничиваются повторными переливаниями крови, назначением препаратов железа. Кортикостероиды не эффективны.
Токсические гемолитические анемии
Этиология. Гемолиз эритроцитов могут вызывать многочисленные вещества хим. и бактериальной природы. Из химических веществ гемолиз чаще вызывают мышьяковистый водород (путём взаимодействия мышьяковистых соединений с сульфгидрильными группами), свинец, соли меди (за счёт угнетения пируваткиназы и других ферментов эритроцитов), хлораты калия и натрия, реже резорцин, нитробензол, анилин. Описаны случаи Гемолитическая анемия при гипербарической оксигенации, после укуса пчёл, пауков.
Патогенез. Механизм гемолиза может быть различным. Гемолиз может происходить вследствие резкого окислительного эффекта (как при энзимопенических анемиях), преодолевающего нормальные защитные механизмы эритроцитов, вследствие нарушения синтеза порфиринов, появления аутоиммунных факторов и др. Разрушение эритроцитов чаще происходит внутрисосудисто. Токсические Гемолитическая анемия могут развиваться при инфекционных заболеваниях. Механизм гемолиза при некоторых из них известен. Так, Bartonella bacilliformis — плазмодии малярии проникают внутрь эритроцитов, которые затем элиминируются селезёнкой. Clostridium welchii образует α-токсин — лецитиназу, взаимодействующую с липидами мембраны эритроцитов с образованием гемолитически активного лизолецитина. При лейшманиозе гемолиз связан со спленомегалией. Возможны и другие механизмы гемолиза — адсорбция бактериальных полисахаридов на эритроцитах с последующим образованием аутоантител, разрушение бактериями поверхностного слоя мембраны эритроцитов с обнажением Т-антигена и полиагглютинабельностью эритроцитов.
Клиническая картина и осложнения. По течению токсические Гемолитическая анемия могут быть острыми и хронический. При острых токсических Гемолитическая анемия возникает внутрисосудистый гемолиз, который проявляется гемоглобинемией, гемоглобинурией, в тяжёлых случаях может сопровождаться явлениями коллапса и анурии. При хронический токсических Гемолитическая анемия преобладает внутриклеточный гемолиз, приводящий к гепато- и спленомегалии, что особенно выражено при малярии и висцеральном лейшманиозе.
Лечение состоит в прекращении контакта с токсическим агентом и применении соответствующих антидотов, а при инфекционных заболеваниях, сопровождающихся Гемолитическая анемия, терапии основного процесса. При тяжёлой анемии показаны заместительные трансфузии. При анурии следует поддерживать диурез путём введения в организм жидкости, в частности щелочных растворов. Количество вводимой жидкости не должно превышать суточного диуреза.
Прогноз. При остром течении токсических Гемолитическая анемия возможен летальный исход; при своевременном выявлении и устранении причины гемолиза наблюдается полное выздоровление. При хронический течении токсических Гемолитическая анемия прогноз также зависит от раннего выявления причины заболевания и устранения её. Гемолиз, сопровождающий некоторые инфекционные заболевания, при лечении инфекции стихает.
Сводные данные о дифференциально-диагностической характеристике Гемолитическая анемия представлены в таблице.
 |
||
 |
||
 |
||
Патологическая анатомия
При Гемолитическая анемия в связи с повышенным разрушением эритроцитов наблюдаются малокровие, желтуха (смотри), гиперплазия костного мозга (смотри), увеличение селезёнки (смотри) и печени (смотри), гемосидероз (смотри) органов и тканей, множественные кровоизлияния и тромбозы сосудов, очаги экстрамедуллярного кроветворения (смотри). Эти изменения выражены в различной степени в зависимости от формы Гемолитическая анемия. При всех формах Гемолитическая анемия обнаруживают жировую дистрофию миокарда, печени, нередко некробиоз и некроз печёночных клеток в центральных отделах долек, возможны цирротические изменения. В мелких сосудах и капиллярах выявляют скопления агрегированных, иногда гемолизированных эритроцитов.
Нередко наблюдают кровоизлияния в органах и тканях, свежие и старые тромбы в сосудах портальной системы, лёгких, головного мозга и так далее
При наследственных Гемолитическая анемия на вскрытии обнаруживают общую желтуху, иногда деформацию костей черепа, часто трофические язвы на ногах. Костный мозг плоских и трубчатых костей сочный, красного цвета, часто с ржавым оттенком.
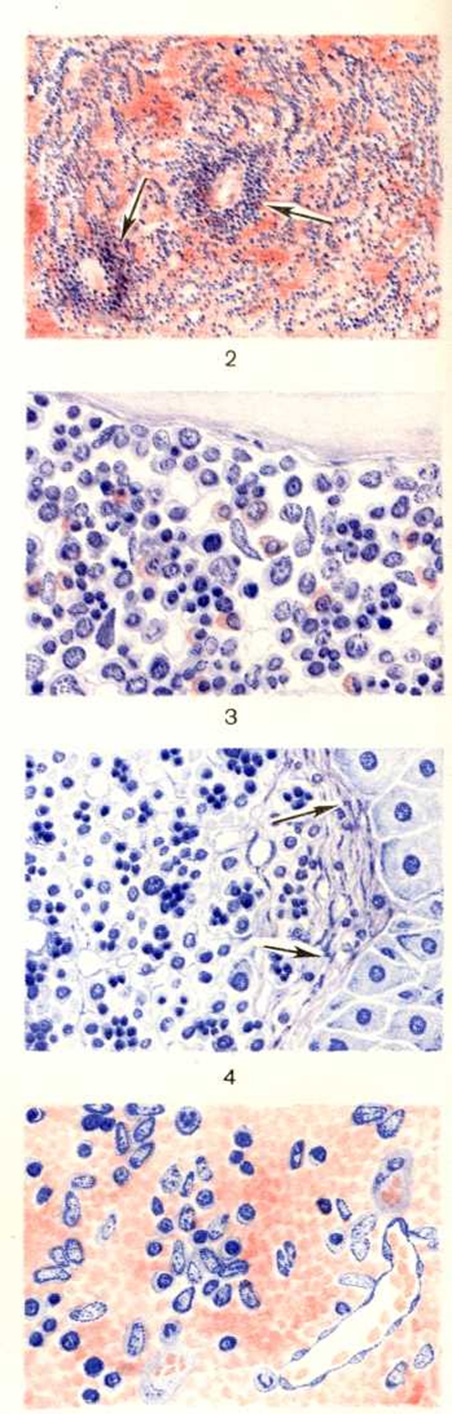
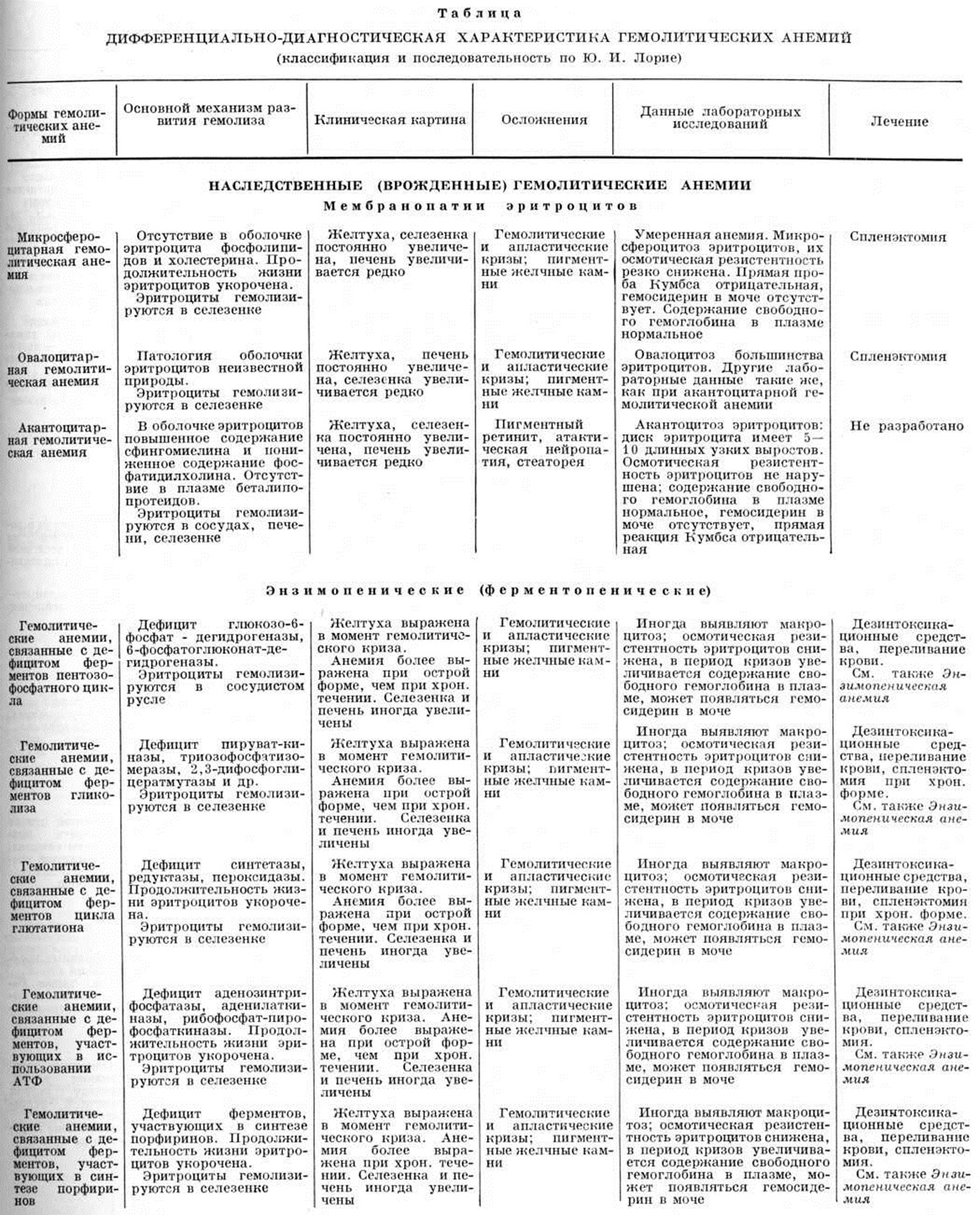
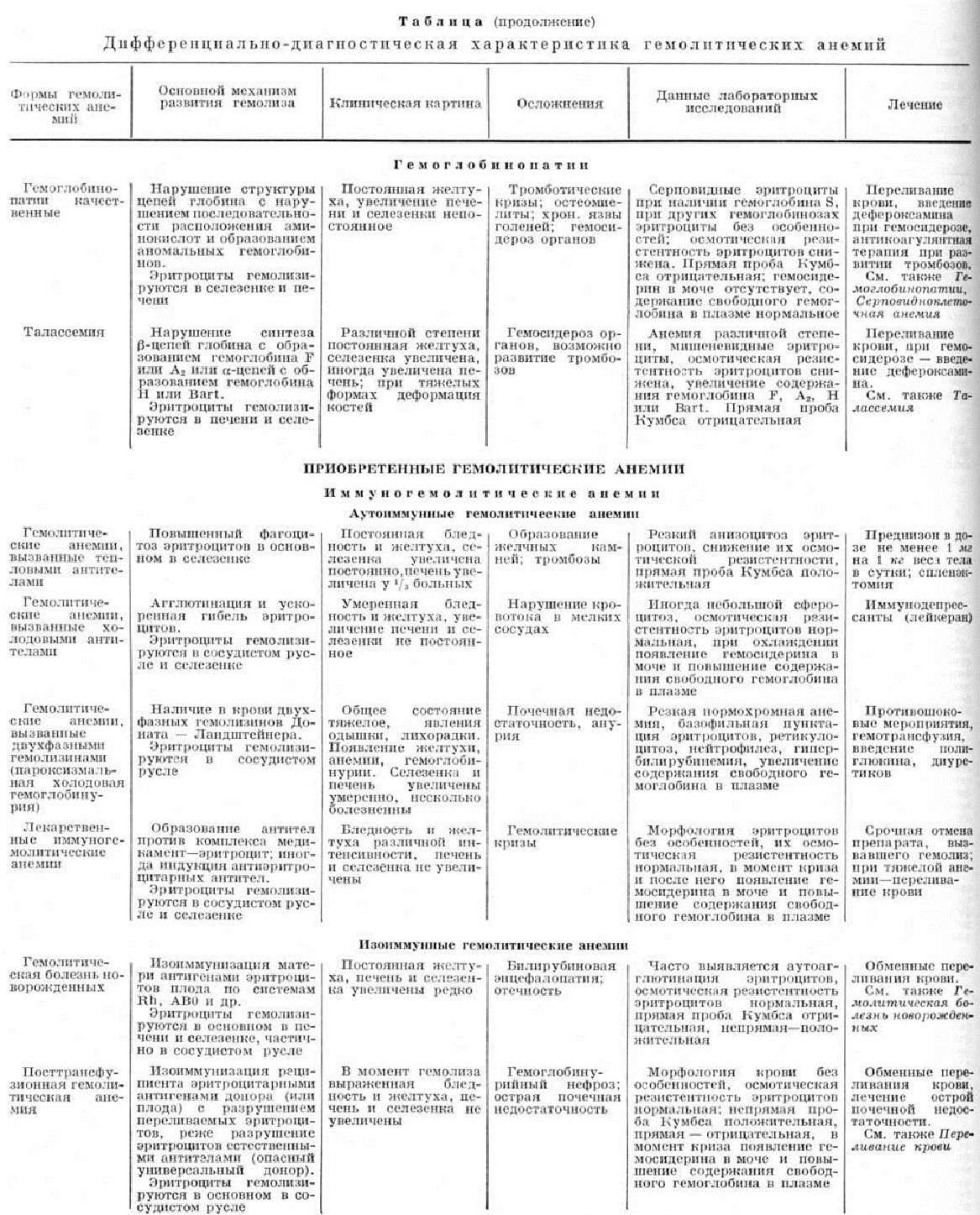
Селезёнка значительно увеличена (до 3,5 килограмм), капсула утолщена, имеются фиброзные спайки с окружающими тканями, поверхность разреза буровато-красного цвета, часты инфаркты, очаговые разрастания соединительной ткани с отложением продуктов распада гемоглобина (так называемый склеро-пигментные узелки). Возможно увеличение печени, лимф, узлов, признаки экстрамедуллярного кроветворения в органах и тканях в виде темно-красных узелков (цветной рисунок 4). Есть описание массивных внекостномозговых разрастаний кроветворной ткани в клетчатке по ходу грудного отдела позвоночника, которые внешне сходны с опухолевыми образованиями. В желчном пузыре и протоках густая тёмная желчь, часто пигментные камни. При гистологический изучении костного мозга обнаруживают его полнокровие, среди клеток преобладают клетки красного ряда — эритробласты и нормобласты, нередко увеличено количество миелоцитов (цветной рисунок 3). Имеется рассасывание костной ткани с очаговым разрушением кортикального слоя кости. В селезёнке, печени, костном мозге, лимф, узлах постоянно наблюдается эритрофагия, но менее выраженная, чем при приобретённой аутоиммунной Гемолитическая анемия. В органах и тканях обнаруживают явления гемосидероза, часто одновременно и безжелезистые продукты распада гемоглобина. Гистологический картина при микросфероцитарной Гемолитическая анемия: фолликулы селезёнки редуцированы, красная пульпа резко полнокровна (цветной рисунок 2), венозные синусы в участках полнокровия имеют вид узких щелей. Много гемолизированных и распадающихся эритроцитов. Эндотелий синусов всегда резко гиперплазирован. В красной пульпе — скопления незрелых клеток красного ряда, сегментоядерных лейкоцитов, лимфоцитов. Склеротические изменения выражены в различной степени.
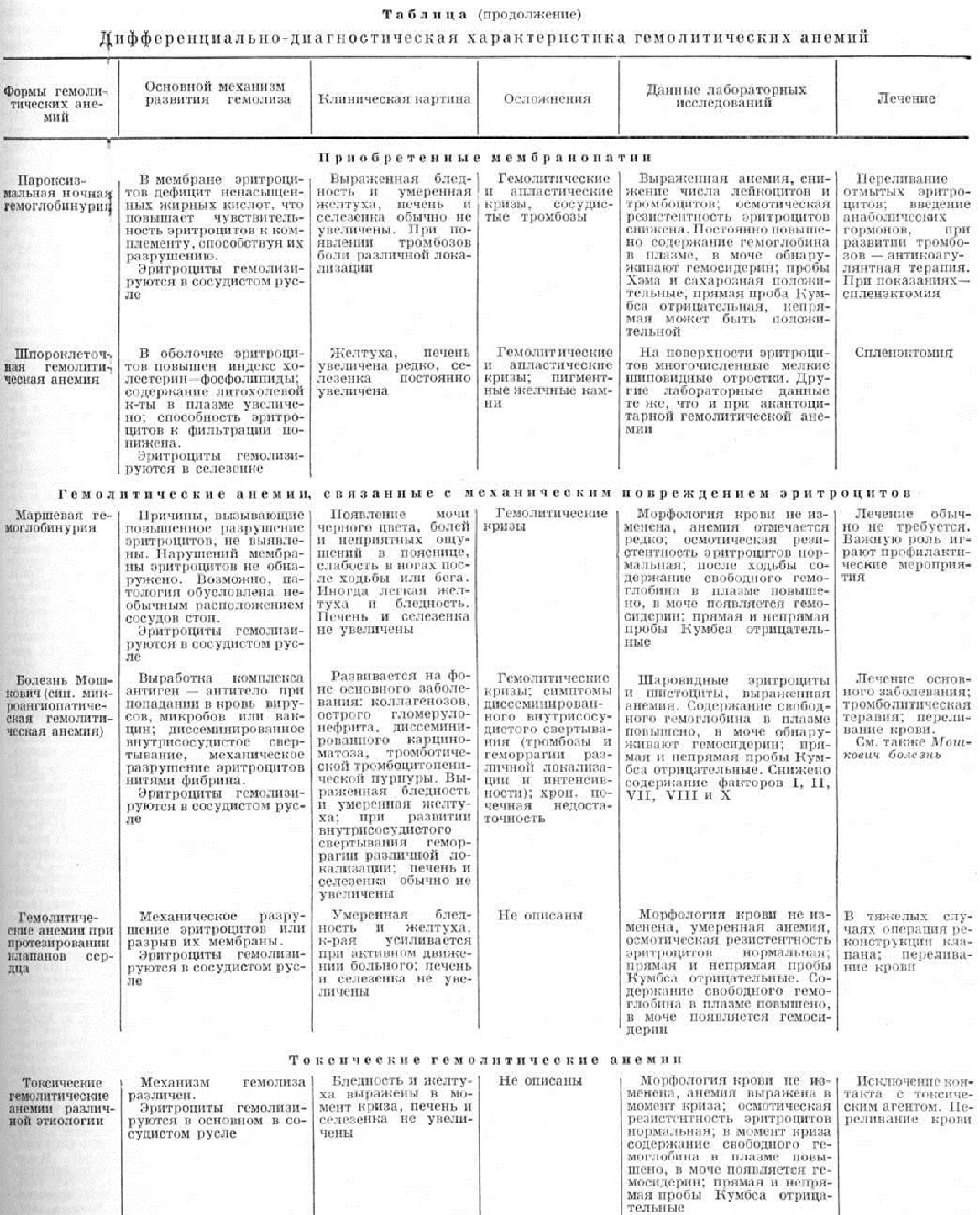
При аутоиммунных Гемолитическая анемия селезёнка обычно увеличена, однако меньше, чем при наследственных Гемолитическая анемия: вес её редко превышает 1 килограмм. При микроскопическом исследовании обнаруживают редукцию фолликулов, полнокровие пульпы, гиперплазию эндотелия синусов, признаки гемолиза эритроцитов, резко выраженную эритрофагию. Отличительной особенностью аутоиммунных Гемолитическая анемия является наличие в селезёнке значительной очаговой (цветной рисунок 5) или диффузной гиперплазии ретикулярных клеток с появлением гигантских форм [Раппапорт, Кросби (Н. Rappaport, W. Н. Crosby), 1957; JI. А. Данилова, 1960; Дейси (J. V. Dacie), 1962; Пировский (В. Pirofsky), 1969]. Указанные клетки проявляют высокую ферментативную активность, значительная пролиферация их соответствует напряжённости иммунологический процесса у больных. Часто наблюдают гемосидероз органов. В просветах канальцев почек иногда видны эритроциты и гемоглобиновые цилиндры. В костном мозге обнаруживают гиперплазию нормо- и эритробластов; нередко имеются дистрофические изменения клеток, возможно развитие участков гипоплазии. В костном мозге описаны ограниченные образования из зрелых лимфоцитов [Андре, Дюамель (R. Andre, G. Duhamel) и другие, 1968]. При симптоматической форме аутоиммунных Гемолитическая анемия, развивающихся при лейкозах, также обнаруживаются описанные выше морфологически признаки повышенного кроверазрушения (А. К. Агеев, 1964).
При пароксизмальной ночной гемоглобинурии на вскрытии отмечают признаки малокровия, нередко желтуху, множественные мелкоточечные кровоизлияния в кожные покровы, серозные и слизистые оболочки. Характерно увеличение размеров и веса почек, расширение коркового слоя, который имеет коричнево-красный цвет. Часто обнаруживают распространённый тромбоз в системе воротной вены, в головном мозге и его оболочках. Вследствие этого в ряде случаев выявляют очаги размягчения вещества головного мозга, инфаркты в различных органах, некрозы стенки тонкого кишечника. В отличие от Гемолитическая анемия с преимущественно внутриклеточным гемолизом, отсутствует выраженное увеличение селезёнки. Последнее отмечается лишь при развитии осложнений (тромбоз селезёночной вены и её внутриорганных разветвлений, инфаркты). Печень увеличена незначительно. Костный мозг плоских и трубчатых костей сочный, темно-красного цвета, может содержать суховатые светло-розовые или желтоватые участки. При гистологический исследовании в почках постоянно обнаруживают массивные отложения гемосидерина в эпителии канальцев, чаще в их проксимальных отделах. В просветах канальцев могут быть скопления свободного гемоглобина, гемолизированных эритроцитов. Описаны дистрофические изменения эпителия и фиброз стромы почек. Отложение гемосидерина в других внутренних органах наблюдается только при назначении больным больших количеств гемотрансфузий. В печени имеется жировая дистрофия, нередко некрозы в центральных отделах долек, особенно при тромбозе внутрипечёночных вен. В костном мозге наряду с гиперплазией ядерных клеток красного ряда могут встречаться различного размера участки опустошения, представленные отёчной стромой, жировыми клетками. Характерно наличие полей кровоизлияний, расширение просвета синусов, скопление в них гемолизированных эритроцитов, эритрофагия. Возможно увеличение числа плазматических и тучных клеток. Количество гранулоцитов в костном мозге уменьшено. Среди мегакариоцитов часто наблюдают дегенеративные формы. В других органах и тканях также обнаруживают морфологически изменения, сопутствующие нарушению кровообращения. В венах различного калибра наряду со свежими тромбами находят и организованные, с явлениями васкуляризации.
Смотри также Анемия.
|
Алексеев Г.А.; Лорие Ю.И.; Хохлова М.П. |

|
⇐ Перейти на главную страницу сайта |
⇑ Вернуться в начало страницы ⇑ |
Библиотека Ordo Deus ⇒ |
⇐ Гемолимфангиэктазии кожи |
⇓ Полный свод знаний. Том первый А. ⇓ |
Гемолитическая болезнь новорожденных ⇒ |
|
Все статьи в полном изложении, Вы можете найти в большой медицинской энциклопедии — Главный редактор: академик АН СССР (РАН) и АМН СССР (РАМН) Б.В. Петровский. — Москва издательство «Советская энциклопедия» 1989г. |
|
Внимание! Вы находитесь в библиотеке «Ordo Deus». Все книги в электронном варианте, содержащиеся в библиотеке «Ordo Deus», принадлежат их законным владельцам (авторам, переводчикам, издательствам). Все книги и статьи взяты из открытых источников и размещаются здесь только для чтения. |
|
Библиотека «Ordo Deus» не преследует никакой коммерческой выгоды. |
|
Все авторские права сохраняются за правообладателями. Если Вы являетесь автором данного документа и хотите дополнить его или изменить, уточнить реквизиты автора, опубликовать другие документы или возможно вы не желаете, чтобы какой-то из ваших материалов находился в библиотеке, пожалуйста, свяжитесь с нами по e-mail: |
Вас категорически не устраивает перспектива безвозвратно исчезнуть из этого мира? Вы не желаете закончить свой жизненный путь в виде омерзительной гниющей органической массы пожираемой копошащимися в ней могильными червями? Вы желаете вернувшись в молодость прожить ещё одну жизнь? Начать всё заново? Исправить совершённые ошибки? Осуществить несбывшиеся мечты? Перейдите по ссылке: «главная страница».
|
© Ordo Deus, 2010. При копировании ссылка на сайт http://www.ordodeus.ru обязательна. |