Стабильность сердечной митохондриальной мембраны после глубокой гипотермии с использованием ксенон-клатратного анабиоза |
||
 |
 |
Оглавление
|
Стабильность сердечной митохондриальной мембраны после глубокой гипотермии с использованием ксенон-клатратного анабиоза
Редакция Ordo Deus приносит, Вам уважаемый читатель, свои извинения за качество перевода. Перевод сделан с помощью программы Гугл переводчик. Оригинал статьи, на английском языке, Вы найдёте внизу страницы. Оригинал статьи Стабильность сердечной митохондриальной мембраны после глубокой гипотермии с использованием ксенон-клатратного анабиоза - Электрон-микроскопическое исследование Сергей Sheleg1, Хью Hixon1, Брюс Cohen1, Дэвид Lowry2 и Михаил Nedzved3. 1Innovative сохранения биологического Technologies LLC, Скоттсдейл, Аризона, США; 2School естественных наук, Университет штата Аризона, Темпе, Аризона, США и 3Pathology департамента, Минский государственный медицинский факультет, г. Минск, Республика Беларусь. Поступила в редакцию 21 октября 2007 года; Принято с ревизией 12 ноября 2007; Имеется в режиме онлайн 1 января 2008. Аннотация: Мы исследовали новый метод криоконсервации использовании ксенона, клатрат-образующего газа, под средним давлением (100 psi). Целью исследования было определить, является ли этот ксенон-клатратный анабиоз мог бы защитить сердечных митохондрий при криогенных температурах (ниже 100 градусов Цельсия). Мы проанализировали просвечивающей электронной микроскопии изображений для получения информации об изменениях в митохондриальной морфологии индуцированных криоконсервации сердца. Наши данные показали отсутствие набуханию митохондрий, разрыв внутренней и внешней мембран, и утечки митохондрий в цитоплазму, после применения этого ксенон-клатратный анабиоз. Электронная микроскопия результаты получены первые доказательства того, что ксенон-клатратный анабиоза с использованием ксенона в качестве клатрат формирования газ под давлением может оказывать защитное воздействие на внутриклеточные мембраны. Это ксенон-клатратный анабиоз технология может найти применение в разработке новых подходов для долгосрочных протоколы криоконсервации. Ключевые слова: электронная микроскопия, сердечной ткани, митохондрии криоконсервации, ксенон-клатратный анабиоз, ксенон, высокое давление, клатраты, стеклование, ткани консервация, орган консервация. Введение давления и температуры условий [5]. Криоконсервации органов стала активная область исследований в 1950-е годы в результате открытия криозащитных свойства глицерина Polge и другие в 1949 году. В последующие четыре десятилетия исследования в этой области, преимущества стеклования, или свободный ото льда криоконсервации, стали очевидными [2]. Несмотря на успешное стеклования человеческих яйцеклеток и кровеносные сосуды, этот метод не был успешным для криоконсервации млекопитающих внутренних органов из-за своей токсичности [3, 4]. Клатратные гидраты представляют собой класс твёрдых тел, в которых молекулы газа занимают "клетки" состоит из водородными связями молекул воды. Эти "клетки" являются неустойчивыми, когда пустые, рушится в обычной кристаллической структуры льда, но они стабилизировались за счёт включения в молекулы газа внутри них. Наиболее низкий молекулярный вес газа (в том числе O≤sub>2≤sub>, N≤sub>2≤sub>, СО≤sub>2≤sub>, CH≤sub>4, H≤sub>2≤sub>S, Ar, Kr, Xe) образуют гидраты при некоторых. Идея использования ксенона в качестве клатрат формирования вещества для анабиоза очень старая и была впервые описана Prehoda [6]. Родин в другие (1984) изучали возможности использования ксенона криопротектора агента в экспериментах в пробирке путём анализа структуры белков в присутствии ксенона клатрат [7]. |
Благородный газ ксенон, который может образовывать клатраты под низким давлением (выше 40 фунтов на квадратный дюйм) может быть альтернативным методом криоконсервации больших биологических объектов, в том числе внутренних органов. Предварительные испытания ксенон-клатратный анабиоз (с использованием газовой смеси ксенона-азот-кислород при температуре от +5° C при высоком давлении) на планарии показал, ксенон клатратообразования в тканях животных и обратимость этой процедуры (неопубликованные данные).
Целью настоящего исследования было определить, является ли ксенон-клатратный анабиоза с использованием ксенона под давлением имеет защитное действие на внутриклеточных мембран кардиомиоцитов.
Материал и методы.
Животные.
Эксперименты были проведены на 10 белых мышей (Mus мышцы) (мужчины, 6-8 недель; 25 ± 2 грамм массы тела). Животные были подвергнуты эвтаназии с галотан (Sigma-Aldrich,. Cat B4388) в соответствии с процедурой, рекомендованной Группой об эвтаназии Американской ветеринарной ассоциации. Сердца были немедленно расчлененных и введён в Corning крио-флаконов (без крышки), содержащий 200 JL кислородом изменение Krebs-Henselite решение (118.4 миллилитров NaCl, 25 миллилитров NaHCO3, 4.7миллилитров KCl, 1,6 KH2PO4, 0,6 MgSO4, 2,5 миллилитров CaCl2, 11миллилитров глюкозы) для защиты сердечной ткани от высыхания.
Крио-флаконов были помещены внутрь камеры давления (рис. 1А), давление с ксенон-кислородной смеси (ксенон - 90psi, кислород - 10PSI) и оставили на льду в течение 15 минут, как показано на рисунке 1b. Контрольные образцы были под давлением с азотно-кислородной смеси (90psi и 10PSI, соответственно). Тогда давление камеры были помещены на стендах в контейнер из пенопласта над жидким азотом для постепенного охлаждения в течение 15 минут, а затем погружают в жидкий азот в течение ещё 15 минут (рис. 1 С).
Барокамеры со всей мышиного сердца нагревают при комнатной температуре в течение 15 минут и открыто. Температура образцов измерялась с помощью Sper Научно 800024 Multi-Input Термопары Термометры (кат. № К-94461-35 от Cole-Parmer Instrument Company, Вернон Хиллс, штат Иллинойс) с гибким Teflon изолированные проволоки термопары.
Электронная микроскопия.
Сердце образцов тканей (3 × 3 × 3 миллилитров) были вырезаны из вершины и сразу же фиксируется в холодную (+4° C) 2,5% глутарового альдегида в 0,1 М натрий буфере Соренсена (электронная микроскопия наук;. Cat 15980). Сердечных образцы оттаивают при комнатной температуре до 0° C, прежде чем положить их в фиксаторы, чтобы избежать фиксации артефактов. Образцы были получены после фиксированного 1% осмия в том же буфере в течение одного часа при комнатной температуре, а затем три раза промывали тем же буфером и в три раза дистиллированной водой. Образцы были окрашены единым блоком с 0,5% уранилацетата течение двух часов при комнатной температуре, затем трижды промывают дистиллированной водой и постепенно обезвоженных с этанолом до перевода в ацетоне. Эпоксидной смолы Spurr был использован для инфильтрации и блоки полимеризоваться в течение 48 часов при 60° C. Тонкие срезы на Leica R Ultracut микротома и пост-окрашенных уранилацетатом и цитратом свинца. Образцы были обнаружены и зарегистрированы в 80kV ускоряющее напряжение на Philips CM-12 Сканирование просвечивающей электронной микроскопии (Нидерланды) в электронной микроскопии и WM Кек Bioimaging лаборатории Университета штата Аризона.
Изображения были записаны на цифровой Gatan 791 прибор с зарядовой связью камера (Gatan, Inc Warrendale, PA). Денситометрия митохондрий проводили с использованием програмиллилитровного обеспечения ImageJ (http:rsb.info.nih.govij). Плотность митохондрий в митохондриях была нормализована против рибосомах шероховатой эндоплазматической сети.
Статистический анализ был проведён по Стьюдента испытаний; значения средних ± SD. Р-значение менее 0,05 считалось статистически значимым.
Результаты
Во время охлаждения под давлением камеры в жидком азоте пара, давление упало в связи с сокращением газ и незначительные утечки.
Температура сердечной образцов -94° ± 2,5° C, сразу после открытия камеры.
Твёрдость сердечной ткани в камере, заполненной ксеноном-кислородной смеси под давлением было по-другому в сравнении с контролем сердечного образцов, которые были прямыми замораживали в жидком азоте. Сердечных образцы были тверды и были легко режется ножом, но не камнем трудно, как в контрольном образце, который был прямо замораживают в жидком азоте при нормальных условиях давления.
Для исследования степени повреждения сердечной ткани после применения ксенон-клатратный анабиоз, основанный на использовании сжатого смесь ксенона и кислорода и управления заморожены под давлением азота-кислородная смесь, трансмиссионной электронной микроскопии ткани сердца была выполнена.
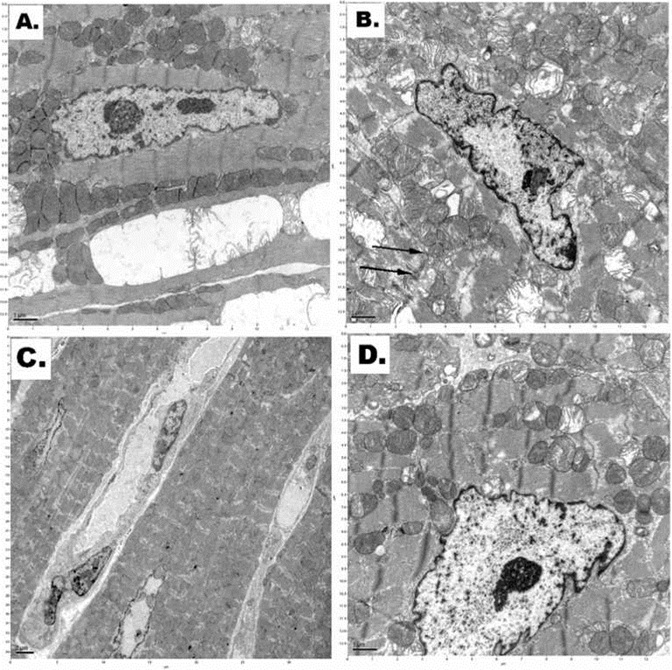
Электронная микроскопия показала, сердечных тканей очевидны и существенные различия в структурах митохондрий кардиомиоцитов ходьбы от различных протоколов криоконсервации, как показано на рисунке 2.
Как показано на рисунке 2, было наличие необратимого повреждения клеток мембраны (например, нарушение миофибрилл и цитоплазматических инвагинации мембраны) кардиомиоциты, которые были прямыми замораживают в жидком азоте при нормальном давлении (рис. 2В).
Там была снижена плотность митохондрий в кардиомиоцитах криоконсервации при высоком давлении азотно-кислородной смеси газов и охлаждения в жидком азоте (рис. 2С).
Относительно хорошо сохранившийся митохондрии присутствуют в кардиомиоциты сердечной образцов после ксенон-клатратный анабиоз применяется протокол (инкубационный высокого давления ксенон-кислородной смеси с последующим охлаждением в жидком азоте) (рис. 2D).
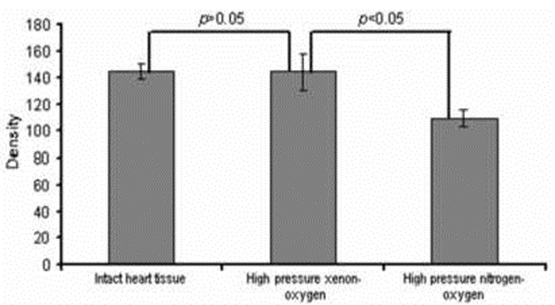
Сравнительный анализ структурных изменений в митохондриях показали сильное снижение плотности митохондрий в сердечной образцов, которые были прямыми замораживали в жидком азоте, по сравнению с обработанными сердечной образцов (рис. 3).
Как видно из гистограммы, плотность митохондрий в сердечной образцы криоконсервированы помощью давлением ксенон-кислородной смеси (ксенон-клатратный анабиоз) был значительно выше (почти как в неповреждённой ткани сердца), чем в митохондриях кардиомиоцитов в образцах, которые были заморожены в герметичном азотно-кислородной смеси. Значение р ≤05 указано статистически значимых различий между ними. Примерно 76% из митохондрий сердечной образцы, которые прошли под давлением ксенон-клатратный анабиоз ксенона процедуры, была та же самая плотность, как ссылка сердечной образцов.
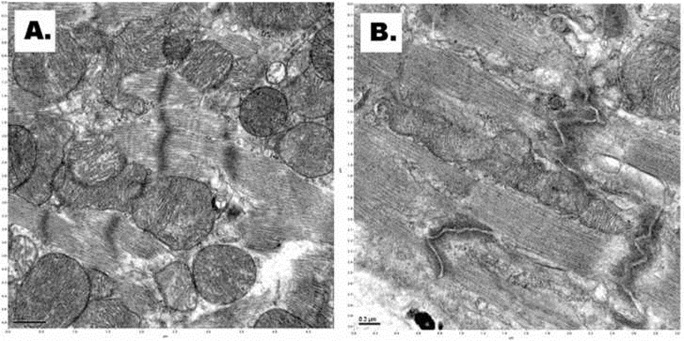
Мы не видели набуханию митохондрий, разрыв внутренней и внешней мембран, и утечки митохондрий в цитоплазму, после применения ксенон-клатратный анабиоз, основанный на использовании сжатого ксенона (рис. 4а). В контрольной сердечной образцов (после замораживания прямо под высоким давлением в азотно-кислородной смеси при 100 psi), электронная микроскопия показала фрагментация внутренней мембране митохондрий, разрыв внутренней и внешней мембран, и утечки митохондрий в цитоплазму (рис. 4В).
 |
|  |
Рисунок 3 | ||
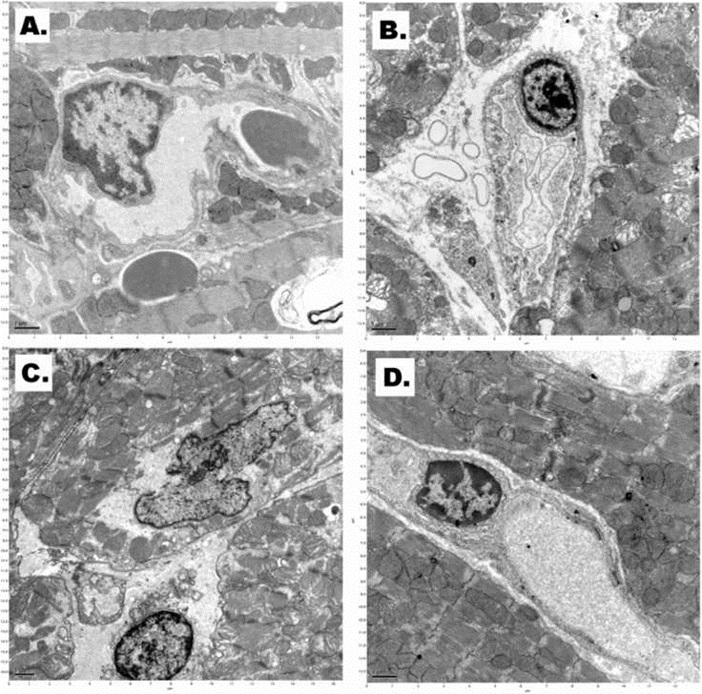
Электронная микроскопия показала диффузные повреждения эндотелия ячейки отмечены периваскулярные отеки место в сердечной образцов после прямой замораживание в жидком азоте при нормальном давлении (рис. 5В). Обширные повреждения капиллярной был в сердечной ткани после инкубации при высоком давлении азотно-кислородной смеси газов и охлаждения в жидком азоте, а также (рис. 5С). Структура эндотелиальных клеток капилляров относительно хорошо сохранившиеся после применяться ксенон-клатратный анабиоз (инкубационный высокого давления ксенон-кислородной смеси с последующим охлаждением в жидком азоте (рис. 5D).
Обсуждение
Живые ткани охлаждается ниже точки замерзания воды пострадали от обезвоживания клеток, как лёд образуется между клетками. Механизм замораживания ущерб в живых тканях было выяснено Renfret (1968) и Мазур (1984) [8, 9]. Образование льда начинается в межклеточных пространствах. Давление пара льда ниже, чем давление пара растворенного вещества воды в окружающие клетки и, как тепло отводится на точке замерзания растворов, кристаллы льда растут между клетками, извлечение воды из них.
Как кристаллы льда растут, объем клетки уменьшается, и клетки дробятся между кристаллами льда. Кроме того, как клетки сжимаются, растворенных веществ внутри клетки сосредоточены в оставшейся воды, повышение внутриклеточной ионной силы и вмешательства в организацию белков и других внутриклеточных структур. В конце концов, концентрация растворенного вещества внутрь клеток достигает эвтектической и замерзает. Конечное состояние замороженных тканей чистого льда в бывшем внеклеточных пространствах, так и внутри клеточных мембран смесь концентрированных клеточных компонентов в лёд и связанной воды. В общем, этот процесс не является обратимым к точке восстановления тканей к жизни, хотя есть редкие исключения наблюдаемые в природе (стеклования полиолов (например, насекомые, земноводные), тепловые белков гистерезиса (насекомые, рыбы) [10, 11].
Большинство повреждений происходит во время разогревания и реперфузии криоконсервированных биологических тканях органах и процесс её развития отнимает много времени [8]. Эти изменения включали конденсации хроматина, крупные капли липидов, и частично разрушены плазматической мембраны и можно увидеть на электронной микроскопии (которая может быть следствием осмотического экскурсии, понесённые во время замораживания-оттаивания; утечки митохондрий могут вызывать апоптоз, а также ). Повреждения при замораживании вызывает, кроме того, из-за температурного стресса к снижению температуры себе, через следующие процессы: необратимые изменения биологических мембран при дегидратации из клеток и
Поверхность оболочек, вызванных замораживанием процесса, уничтожение потерь в избирательной проницаемости или физические деформации и гибели клетки. Световая микроскопия не показывают раннее замерзание к повреждению клеток.
ксенон-клатратный анабиоз технология основана на концепции формирования клатраты (ксенона, гексафторида серы, фреона-23 и тому подобное) в клетках, тем самым уменьшая обезвоживания. Биологические ткани могут быть насыщены клатрат образующего газа (ов) путём диффузии или перфузии в соответствующее давление в диапазоне 1-50 бар при температуре выше клатрат формирования температуры. После насыщения тканей охлаждается, прежде ниже клатрат формирования температуры, но выше точки замерзания воды, то к температуре, при которой клатраты являются метаболически стабильных при атмосферном давлении и давлении пустили на окружающую среду. Ткань затем постепенно охлаждается до нужной температуры некоторые при нормальном атмосферном давлении и хранятся неопределённо долгое время.
Это ксенон-клатратный анабиоз метод может защитить ткани от удержания воды внутри клеток клатратообразования воды с введённым газов, ограничивающих образование льда вне клеток.
Ксенон является почти идеальным клатрат-образующего газа, образуя клатраты выше 0° С при относительно низком давлении (двух атмосфер) [12, 13]. Ксенон имеет высокую проницаемость кожи, а также [14]. Даже ранние объяснения для анестезии ксеноном даётся Полинг (1961) и Miller (1961) предположил, что клатрат структуры гидрата инкапсуляции атомов инертных газов образуются вблизи синапсов, препятствующие межнейронных передачи [15, 16].
Использование ксенона под высоким давлением (которая является высокой проницаемостью) может предотвратить клетки от замерзания повреждений, вызванных внутриклеточными обезвоживания. Наши результаты также показали отсутствие набуханию митохондрий, разрыв внутренней и внешней мембран, и утечки митохондрий в цитоплазму, после применения ксенон-клатратный анабиоз в сравнении с замораживанием под высоким давлением азота. Межклеточные замораживания причин повреждения, не столько в процессе замораживания, а в процессе оттаивания, во время которого ре кристаллизации может происходить [17]. Ксеноновые клатратов легко ломаются, как перепады давления, без внутриклеточной воды повторно кристаллизации (по сравнению с повреждений после внутриклеточное образование кристаллов льда).
Кардиомиоцитов служить лучшей моделью для изучения динамики повреждение митохондрий в клинической и экспериментальной патологии.
Сафиулина и другие (2006) показали, что потеря митохондриального мембранного потенциала приводит к набуханию митохондрий [18]. Известно, что постоянное ишемия приводит к потере матрицы плотности, и это связано с набуханию митохондрий [19]. Ещё одним важным признаком тяжёлого повреждения клеток является инвагинации цитоплазматической мембраны. Это было замечено в наш контроль сердечного образцов после прямого замораживания в жидком азоте. Это морфологический вывод Особенно это заметно после применения процедуры криоконсервации и указывает на повреждения мембран [20]. Митохондриальная гомеостаза объем уборки функцию, которая имеет важное значение для поддержания структурной целостности органелл [21]. Набуханию митохондрий также является одним из ключевых игроков в цитохрома С релизе, связанные с апоптоз клеток.
Наши исследования использовались электронная микроскопия криоконсервированных сердечной образцы, потому что этот метод может легко обнаружить любой ультраструктурным морфологических изменений после применения криоконсервации протоколов. Мы не сравнить нашу работу с стеклования протоколов. Витрификация требует пропитки биологических тканей с высокой концентрацией криозащитных химических веществ, которые способствуют стекловидное состояние, но эти ядовиты. В то время как стеклование предотвращает опасные эффект образования льда, новые потенциальные механизмы травмы, связанные с аморфном состоянии были определены [22]. Расстекловывания (образование льда во время потепления) является ещё одним важным препятствием на пути успешного стеклования органа.
Мы предположили, что ксенон клатраты может защитить митохондрий кардиомиоцитов от замерзания повреждения. Хотя ксенон клатратообразования может быть достигнуто выше нуля по Цельсию, что мы хотели видеть степень внутриклеточного повреждения мембраны после воздействия криогенных температур. Мы показали, что мембраны митохондрий были менее повреждены после ксенон-клатратный анабиоз применяется протокол по сравнению с контролем сердечного образцов, которые были прямыми замораживали в жидком азоте. Криоконсервация под давлением азота-кислородная смесь также не было никакой выгоды. Измерение концентрации кардиолипину (сотовая распространение которых ограничено митохондрии, она служит признаком тяжёлого повреждения митохондриальной мембраны в соответствии с Virag и другие (1998) при тестировании ксенон-клатратный анабиозы можно легко сделать, и является оправданным в дальнейшем исследовании этой процедуры ксенон-клатратный анабиоз [23].
Благодарности
Мы признаем, доктор Роберт Робинсон (Школа естественных наук, Университет штата Аризона, Темпе, Аризона) для электронной микроскопии. Этот исследовательский проект был поддержан инновационных биологических технологий ООО сохранение, Скоттсдейл, Аризона 85262.
Вы можете обратиться соответствий Сергей Шелег, доктор философии, Biodesign институт, Университет штата Аризона, Темпе, Аризона 85287. E-mail: Sergey.Sheleg @ asu.edu
|
Кохен Б.; Лоури Д.; Неджед М.; Хиксон Х.; Шелег С. |
|
⇐ Перейти на главную страницу сайта |
⇑ Вернуться в начало страницы ⇑ |
Библиотека Ordo Deus ⇒ |
⇐ Каталог заглавий |
⇓ Полный свод знаний. Том первый А. ⇓ |
Каталог систематический ⇒ |
Original Article
Cardiac Mitochondrial Membrane Stability after Deep Hypothermia using a Xenon Clathrate Cryostasis Protocol - an Electron Microscopy Study
Sergey Sheleg1, Hugh Hixon1, Bruce Cohen1, David Lowry2 and Mikhail Nedzved3
1Innovative Biological Preservation Technologies LLC, Scottsdale, AZ, USA; 2School of Life Sciences, Arizona State University, Tempe, AZ, USA and 3Pathology Department, Minsk State Medical School, Minsk, Republic of Belarus
Received 21 October 2007; Accepted with revision 12 November 2007; Available online 1 January 2008
Abstract: We investigated a new cryopreservation method using xenon, a clathrate-forming gas, under medium pressure (100psi). The objective of the study was to determine whether this cryostasis protocol could protect cardiac mitochondria at cryogenic temperatures (below 100 degrees Celsius).We analyzed transmission electron microscopy images to obtain information about changes in mitochondrial morphology induced by cryopreservation of the hearts. Our data showed absence of mitochondrial swelling, rupture of inner and outer membranes, and leakage of mitochondrial matrix into the cytoplasm after applying this cryostasis protocol. The electron microscopy results provided the first evidence that a cryostasis protocol using xenon as a clathrate-forming gas under pressure may have protective effects on intracellular membranes. This cryostasis technology may find applications in developing new approaches for long-term cryopreservation protocols.
Key Words: Electron microscopy, cardiac tissue, mitochondria, cryopreservation, cryostasis, xenon, high pressure, clathrates, vitrification, tissue banking, organ banking
Introduction pressure-temperature conditions [5].
The cryopreservation of organs became an active area of research in the 1950s as a result of the discovery of the cryoprotective properties of glycerol by Polge et al in 1949
. Over the ensuing four decades of research in this area, the advantages of vitrification, or ice-free cryopreservation, have become apparent [2]. Despite successful vitrification of human ova and blood vessels, this method was not successful for cryopreservation of mammalian internal organs because of its toxicity [3, 4].
Clathrate hydrates are a class of solids in which gas molecules occupy “cages” made up of hydrogen-bonded water molecules. These “cages” are unstable when empty, collapsing into conventional ice crystal structure, but they are stabilized by the inclusion of the gas molecule within them. Most low molecular weight gases (including O2, N2, CO2, CH4, H2S, Ar, Kr, and Xe) will form a hydrate under some
The idea of using xenon as a clathrate-forming substance for suspended animation is very old and was first described by Prehoda [6]. Rodin at al (1984) studied the possibility of using xenon as a криопротектора agent in experiments in vitro by analyzing protein structure in the presence of xenon clathrate [7].
The noble gas xenon, which can form clathrates under low pressure (above 40 psi) can be an alternative method for cryopreservation of large biological objects, including internal organs. Preliminary tests of the cryostasis protocol (using a gaseous mixture of xenon-nitrogen-oxygen at +5°C under high pressure) on Planaria showed xenon clathrate formation in the animal tissue and the reversibility of this procedure (unpublished data).
The objective of the present study was to determine whether the cryostasis protocol using xenon under pressure has protective effects on the intracellular membranes of cardiomyocytes.
Material and Methods
Animals
The experiments were performed on 10 albino mice (Mus musculus) (male, 6-8 weeks old; 25±2 грамм body weight). The animals were euthanized with Halothane (Sigma-Aldrich; Cat. B4388) according to the procedures recommended by the Panel on Euthanasia of the American Veterinary Association. The hearts were immediately dissected and put into Corning cryo-vials (without the caps) containing 200jL of oxygenated modified Krebs-Henselite solution (118.4миллилитров NaCl, 25миллилитров NaHCO3, 4.7миллилитров KCl, 1.6миллилитров KH2PO4, 0.6миллилитров MgSO4, 2.5миллилитров CaCl2, 11миллилитров glucose) to protect the cardiac tissue from drying.
The cryo-vials were put inside the pressure chamber (Figure 1A), pressurized with xenon- oxygen mixture (xenon — 90psi, oxygen — 10psi) and left on ice for 15 minutes as shown in Figure 1B. The control samples were pressurized with nitrogen-oxygen mixture (90psi and 10psi, respectively). Then the pressure chambers were put on stands in a styrofoam container over liquid nitrogen for gradual cooling for 15 minutes and subsequently were immersed in liquid nitrogen for another 15 minutes (Figure 1C).
The pressure chambers with the whole murine hearts were warmed at room temperature for 15 minutes and opened. The temperature of the samples was measured using the Sper Scientific 800024 Multi-Input Thermocouple Thermometers (Cat. K-94461-35 from Cole- Parmer Instrument Company, Vernon Hills, Illinois) with the flexible Teflon-insulated-wire thermocouple probe.
Electron Microscopy
The heart tissue specimens (3×3×3mm) were cut from the apex and immediately fixed in cold (+4°C) 2.5% glutaraldehyde in 0.1M Sorensen's sodium buffer (Electron Microscopy Sciences; Cat. 15980). The cardiac samples were thawed at room temperature to 0°C before putting them in a fixative to avoid any fixation artifacts. Samples were post-fixed with 1% osmium tetroxide in the same buffer for one hour at room temperature, and then washed three times with the same buffer and three times with distilled water. Samples were stained en bloc with 0.5% uranyl acetate for two hours at room temperature, then washed three times with distilled water and gradually dehydrated with ethanol before being transferred to acetone. Spurr's epoxy resin was used for infiltration and blocks were polymerized for 48 hours at 60°C. Thin-sections were cut on a Leica Ultracut R microtome and post-stained with uranyl acetate and lead citrate. Samples were observed and recorded at 80kV accelerating voltage on a Philips CM-12 Scanning Transmission Electron Microscope (the Netherlands) at the Electron Microscopy and W.M. Keck Bioimaging Laboratory at Arizona State University.
Images were recorded digitally on a Gatan 791 charge-coupled device camera (Gatan, Inc., Warrendale, PA). Densitometry of the mitochondrial matrix was performed using ImageJ software (http:rsb.info.nih.govij). Density of the mitochondrial matrix in mitochondria was normalized against the ribosomes of the rough endoplasmic reticulum.
Statistical analysis was done by Student's t- test; values are mean ± SD. A p-value of less than 0.05 was considered statistically significant.
Results
During cooling down the pressurized chambers in liquid nitrogen vapor, the pressure dropped due to gas contraction and minor leakage.
The temperature of the cardiac samples was - 94±2.5°C just after opening the chamber.
The hardness of the cardiac tissue in the chamber filled with xenon-oxygen mixture under pressure was different in comparison with the control cardiac samples which were straight frozen in liquid nitrogen. The cardiac samples were firm and were easily cut with a blade, but not stone-hard as in the control sample, which was straight frozen in liquid nitrogen under normal pressure conditions.
To investigate the extent of the damage of the cardiac tissue after application of the cryostasis protocol based on the use of the pressurized mixture of xenon and oxygen and the controls frozen under the pressurized nitrogen-oxygen mixture, transmission electron microscopy of the cardiac tissue was performed.
Electron microscopy of the cardiac tissues showed obvious and significant differences in the cardiomyocytes' mitochondria structures from the different cryopreservation protocols as shown in Figure 2.
As shown in Figure 2, there was the presence of irreversible cellular membrane damage (such as disruption of myofibrils and cytoplasmic membrane invaginations) of the cardiomyocytes, which were straight frozen in liquid nitrogen under normal pressure (Figure 2B).
There was decreased density of the mitochondrial matrix in cardiomyocytes cryopreserved at high pressure nitrogen- oxygen gas mixture and cooling in liquid nitrogen (Figure 2C).
Relatively well-preserved mitochondria were present in cardiomyocytes of the cardiac samples after applied cryostasis protocol (incubation in high-pressure xenon-oxygen mixture followed by cooling in liquid nitrogen) (Figure 2D).
Comparative analysis of structural changes in mitochondria revealed a strong diminution in density of the mitochondrial matrix in the cardiac samples which were straight frozen in liquid nitrogen, compared with the treated cardiac samples (Figure 3).
As shown in the histogram, the density of the mitochondrial matrix in the cardiac samples cryopreserved using a pressurized xenon- oxygen mixture (cryostasis protocol) was much higher (almost like in the intact cardiac tissue) than in mitochondria of cardiomyocytes in the samples, which were frozen in the pressurized nitrogen-oxygen mixture. A p-value of ≤.05 indicated a statistically significant difference between. Approximately 76% of mitochondria of the cardiac samples, which underwent the pressurized xenon cryostasis procedure, had the same density as the reference cardiac samples.
We did not see mitochondrial swelling, rupture of inner and outer membranes, and leakage of mitochondrial matrix into the cytoplasm after applying the cryostasis protocol based on using of pressurized xenon (Figure 4A). In the control cardiac samples (after straight freezing under high pressure in nitrogen-oxygen mixture at 100psi), electron microscopy demonstrated fragmentation of the mitochondrial inner membrane, rupture of inner and outer membranes, and leakage of mitochondrial matrix into the cytoplasm (Figure 4B).
 |

|  |
Figure 3 | ||
Electron microscopy showed diffuse endothelial cell damage marked perivascular space edema in the cardiac samples after straight freezing in liquid nitrogen under normal pressure (Figure 5B). Extensive capillary damage was in cardiac tissue after incubation at high-pressure nitrogen-oxygen gas mixture and cooling in liquid nitrogen as well (Figure 5C). Structure of capillary endothelial cells was relatively well preserved after applied cryostasis (incubation in high-pressure xenon-oxygen mixture followed by cooling in liquid nitrogen (Figure 5D).
Discussion
Living tissues cooled below the freezing point of water are damaged by the dehydration of the cells as ice is formed between the cells. The mechanism of freezing damage in living tissues has been elucidated by Renfret (1968) and Mazur (1984) [8, 9]. Ice formation begins in the intercellular spaces. The vapor pressure of the ice is lower than the vapor pressure of the solute water in the surrounding cells and as heat is removed at the freezing point of the solutions, the ice crystals grow between the cells, extracting water from them.
As the ice crystals grow, the volume of the cells shrinks, and the cells are crushed between the ice crystals. Additionally, as the cells shrink, the solutes inside the cells are concentrated in the remaining water, increasing the intracellular ionic strength and interfering with the organization of the proteins and other intracellular structures. Eventually, the solute concentration inside the cells reaches the eutectic and freezes. The final state of frozen tissues is pure ice in the former extracellular spaces, and inside the cell membranes a mixture of concentrated cellular components in ice and bound water. In general, this process is not reversible to the point of restoring the tissues to life, although there are occasional exceptions observed in nature (vitrifying polyols (i.e., insects, amphibians), thermal hysteresis proteins (insects, fish) [10, 11].
Most lesions occur during re-warming and reperfusion of the cryopreserved biological tissuesorgans and the process of its development is time-consuming [8]. These changes included condensation of chromatin, large lipid droplets, and partly disrupted plasma membrane and can be seen on electron microscopy (which can be a consequence of the osmotic excursions incurred during a freeze-thaw cycle; leakage of mitochondrial matrix can trigger apoptosis as well). Damage by freezing is caused, besides temperature stress owing to decrease in temperature itself, through the following processes: irreversible change of biological membrane by dehydration from the cells and
surface of the membranes caused by freezing process, destruction by loss in selective permeability or physical deformation and death of cell. Light microscopy doesn't show early freezing damage to the cells.
The cryostasis technology is based on the concept of forming clathrates (xenon, sulfur hexafluoride, Freon-23, etc.) within the cells, thus reducing dehydration. Biological tissues can be saturated with the clathrate-forming gas(es) by diffusion or perfusion at the appropriate pressure in the range 1-50 bars at a temperature above clathrate-forming temperature. After saturation, the tissue is cooled, first below the clathrate-forming temperature, but above the freezing point of water, then to a temperature where the clathrates are metabolically stable at ambient pressure, and the pressure allowed to go to ambient. The tissue is then gradually cooled down to some appropriate temperature at normal atmospheric pressure and stored an indefinite time.
This cryostasis method may protect tissues by retention of water inside the cells by clathrate formation of the water with the introduced gases, limiting the formation of ice outside the cells.
Xenon is a nearly ideal clathrate-forming gas, forming clathrates above 0°C under relatively low pressure (two atmospheres) [12, 13]. Xenon has high skin permeability as well [14]. Even an early explanation for xenon anesthesia given by Pauling (1961) and Miller (1961) suggested that clathrate hydrate structures encapsulating the rare gas atoms are formed near synapses, impeding interneuronal transmission [15, 16].
Using xenon under high pressure (which is highly permeable) may prevent cells from freezing damage caused by intracellular dehydration. Our results also showed absence of mitochondrial swelling, rupture of inner and outer membranes, and leakage of mitochondrial matrix into the cytoplasm after applying the cryostasis protocol in comparing with freezing under high pressure of nitrogen. Intercellular freezing causes damage, not so much during the freezing process but rather in the course of thawing, during which re¬crystallization can occur [17]. Xenon clathrates are easily broken as the pressure drops, without intracellular water recrystallization (compared to damage after intracellular ice crystal formation).
Cardiomyocytes serve as the best model to study dynamics of mitochondrial damage in clinical and experimental pathology.
Safiulina et al (2006) demonstrated that loss of mitochondrial membrane potential leads to mitochondrial swelling [18]. It is well known that permanent ischemia causes loss of matrix density, and this is associated with mitochondrial swelling [19]. Another important sign of severe cellular damage is invagination of the cytoplasmic membrane. This was seen in our control cardiac samples after straight freezing in liquid nitrogen. This morphologic finding is especially seen after applying the cryopreservation procedures and indicates membrane damage [20]. Mitochondrial volume homeostasis is a housekeeping function that is essential for maintaining the structural integrity of the organelle [21]. Mitochondrial swelling is also one of the key players in cytochrome c release associated with apoptotic cell death.
Our study used electron microscopy of the cryopreserved cardiac samples because this method can easily detect any ultrastructural morphologic changes after applying cryopreservation protocols. We did not compare our work with vitrification protocols. Vitrification requires the impregnation of biological tissues with high concentrations of cryoprotective chemicals that promote the vitreous state, but these are somewhat toxic. While vitrification prevents the hazardous effect of ice formation, new potential mechanisms of injury associated with the amorphous state have been identified [22]. Devitrification (ice formation during warming) is another major obstacle to successful organ vitrification.
We hypothesized that xenon clathrates could protect cardiomyocyte mitochondria from freezing damage. Although xenon clathrate formation can be accomplished above zero Celsius, we wanted to see the extent of intracellular membrane damage after exposure to cryogenic temperatures. We showed that the mitochondrial membranes were less damaged after the applied cryostasis protocol compared to the control cardiac samples, which were straight frozen in liquid nitrogen. Cryopreservation under a
pressurized nitrogen-oxygen mixture also did not have any benefits. Measuring the concentration of cardiolipin (the cellular distribution of which is restricted to mitochondria; it serves as a sign of severe mitochondrial membrane damage according to Virag et al (1998) during testing the cryostasis protocols can be easily done and is warranted in the future study of this cryostasis procedure [23].
Acknowledgments
We acknowledge Dr. Robert Roberson (School of Life Sciences, Arizona State University, Tempe, AZ) for electron microscopy. This research project was supported by Innovative Biological Preservation Technologies LLC, Scottsdale, AZ 85262.
Please address all correspondences to Sergey Sheleg, Ph.D., The Biodesign Institute, Arizona State University, Tempe, AZ 85287. Email: Sergey.Sheleg@asu.edu
References
Polge C, Smith AU and Parkes AS. Revival of spermatozoa after vitrification and dehydration at low temperatures. Nature 1949;164:666.
Fahy GM, Wowk B, Wu J, Phan J, Rasch C, Chang A and Zendejas E. Cryopreservation of organs by vitrification: perspectives and recent advances. Cryobiology 2004;48:157-178.
Song YC, Khirabadi BS, Lightfoot FG, Brockbank KGM and Taylor MJ: Vitreous cryopreservation maintains the function of vascular grafts. Nat Biotechnol 2000;18:296- 299.
Karlsson JO. Cryopreservation: freezing and vitrification. Science 2002;296:655-656.
Englezos P. Clathrate hydrates. Ind Eng Chem Res 1993;32:1251-1274.
Prehoda RW (Ed) Suspended Animation. Chilton Book Co., Philadelphia, 1969, pp81-86.
Rodin VV, Isangalin FSH and Volkov VYA. Structure of protein solutions in a presence of xenon clathrate. Cryobiology & Cryo-Medicine. Navukova Domka, Kiev, 1984, pp3-7 (in Russian).
Renfret AP. Cryobiology: some fundamentals in surgical context. In: Cryosurgery. Rand RW, Renfret AP and von Leden H (Eds). Springfield, IL, 1968, pp112-115.
Mazur P. Freezing of living cells: mechanisms and implications. Am J Physiol 1984;247:125- 142.
Fletcher GL, Hew CL and Davies PL. Antifreeze proteins of teleost fishes. Annu Rev Physiol 2001;63:359-590.
Graham LA, Liou YC, Walker VK and Davies PL. Hyperactive antifreeze protein from beetles. Nature 1997;388:727-728.Istomin VA and Yakushev VS. In: Gas Hydrates in Nature. Nedra, Moscow, Russia 1992, p32 (in Russian).
Ohgaki K, Sugahara T, Suzuki M and Jindai H. Phase behavior of xenon hydrate system. Fluid Phase Equilibria 2000;175:1-6.
Pauling L. A molecular theory of general anesthesia. Science 1961;134:15-21.
Miller S. A theory of gaseous anesthetics. Proc Natl Acad Sci USA 1961;47:1515-1524.
Mirtov AV, Tarashukhin VR and Peschanskii KI. [Permeability of the skin for xenon absorption]. Med Radiol (Mosk) 1973;18:26-28 (in Russian).
Acker JP and McGrann LE. Protective effect of intracellular ice during freezing? Cryobiology 2003;46:197-202.
Safiulina D, Veksler V, Zharkovsky A and Kaasik A. Loss of mitochondrial membrane potential is associated with increase in mitochondrial volume: physiological role in neurons. J Cell Physiol 2006;206:347-353.
Schild L, Huppelsberg J, Kahlert S, Keilhoff G and Reiser G. Brain mitochondria are primed by moderate Ca2+ rise upon hypoxia reoxygenation for functional breakdown and morphological disintegration. J Biol Chem 2003;278:25454-25460.
Popelkova M, Chrenek P, Pivko J, Makarevich AV, Kubovicova E and Kacmarik J. Survival and ultrastructure of gene-microinjected rabbit embryos after vitrification. Zygote 2005;13: 283-293.
Kaasik A, Safiulina D, Zharkovsky A and Veksler V. Regulation of mitochondrial matrix volume. Am J Physiol Cell Physiol 2007;292: C157-163.
Fahy GM. Biological effects of vitrification and devitrification. In: The Biophysics of Organ Preservation. Pegg DE and Karow AM Jr (Eds). New York, Plenum Publishing Corp., 1987, pp265-297.
Virag L, Salzman AL and Szabo C. Poly(ADP- ribose) synthetase activation mediates mitochondrial injury during oxidant-induced cell death. J Immunol 1998;161:3753-3759.
|
Внимание! Вы находитесь в библиотеке «Ordo Deus». Все книги в электронном варианте, содержащиеся в библиотеке «Ordo Deus», принадлежат их законным владельцам (авторам, переводчикам, издательствам). Все книги и статьи взяты из открытых источников и размещаются здесь только для чтения. |
|
Библиотека «Ordo Deus» не преследует никакой коммерческой выгоды. |
|
Вся информация на сайте Ordo Deus находится в свободном доступе. Ordo Deus не предоставляет информацию на платной основе. |
|
Все авторские права сохраняются за правообладателями. Если Вы являетесь автором данного документа и хотите дополнить его или изменить, уточнить реквизиты автора, опубликовать другие документы или возможно вы не желаете, чтобы какой-то из ваших материалов находился в библиотеке, пожалуйста, свяжитесь с нами по e-mail: |
Вас категорически не устраивает перспектива безвозвратно исчезнуть из этого мира? Вы не желаете закончить свой жизненный путь в виде омерзительной гниющей органической массы пожираемой копошащимися в ней могильными червями? Вы желаете вернувшись в молодость прожить ещё одну жизнь? Начать всё заново? Исправить совершённые ошибки? Осуществить несбывшиеся мечты? Перейдите по ссылке: «главная страница».
|
© Ordo Deus, 2010. При копировании ссылка на сайт http://www.ordodeus.ru обязательна. |