Способ криоконсервации мультипотентных мезенхимальных стромальных клеток |
||
 |
 |
Оглавление
|
Способ криоконсервации мультипотентных мезенхимальных стромальных клетокАвторы: Макеев Олег Германович, Понамарев Александр Игоревич, Коротков Артем ВладимировичПатентообладатели: Макеев Олег Германович, Понамарев Александр Игоревич, Коротков Артем Владимирович.РОССИЙСКАЯ ФЕДЕРАЦИЯ
ФЕДЕРАЛЬНАЯ СЛУЖБА ПО ИНТЕЛЛЕКТУАЛЬНОЙ СОБСТВЕННОСТИ, ПАТЕНТАМ И ТОВАРНЫМ ЗНАКАМЗаявка: 2010122298/10, 01.06.2010Дата начала отсчета срока действия патента: 01.06.2010 Приоритет(ы): Дата подачи заявки: 01.06.2010 Список документов, цитированных в отчете о поиске: RU 2303631 C1, 27.07.2007. RU 2268590 C1, 27.01.2006. ЩЕРБАКОВ П.В. и др. Бессмертие под газом. Химия и жизнь, 2006, n8, с.34-39. Анабиоз клатратный. Найдено в Интернет [22.03.2011] по адресу http://www.ordodeus.ru/Ordo-Deus2e-d.html. US 20090286220 A1, 19.11.2009, реферат DWPI. Адрес для переписки: 620075, г.Екатеринбург, ул. К. Либкнехта, 42, УрГСХА, ОНРИ, Ю.А. Кирсанову СПОСОБ КРИОКОНСЕРВАЦИИ МУЛЬТИПОТЕНТНЫХ МЕЗЕНХИМАЛЬНЫХ СТРОМАЛЬНЫХ КЛЕТОК Реферат: Изобретение относится к области биотехнологии, конкретно к криоконсервации клеточных суспензий человека, и может быть использовано в медицине. Способ криоконсервации мультипотентных мезенхимальных стромальных клеток (ММСК) включает подготовку смеси культуры в культуральной среде, смешивание культуры клеток в культуральной среде с криопротектором, ступенчатое контролируемое охлаждение и замораживание смеси культуральной среды с криопротектором до температуры хранения и последующее хранение замороженной смеси при низких температурах. При этом в качестве криопротектора для насыщения смеси используют газ ксенон, вводимый до насыщения в подготовленную смесь клеточной культуры ММСК в среде DMEM, находящуюся в открытых криопробирках путем продувания культуральной среды ксеноном при 0°С с дальнейшим охлаждением и образованием первичного монолита культуральной среды с криопротектором, направляемым затем на замораживание до температуры хранения. Изобретение обеспечивает сохранность клеток при криоконсервации. 2 з.п. ф-лы, 2 ил., 2 табл. |
|||||||||||||
 |
|  |
| ||
Изобретение относится к медицине, точнее к криобиологии, в частности к способам и препаратам для криоконсервации клеточных суспензий человека, используемых в качестве лечебных препаратов.
На сегодняшний день существует множество способов (протоколов) криоконсервации клеточных суспензий человека. Все известные способы и методики отличаются друг от друга лишь различиями концентрации добавляемых жидких криофилактиков, применением различных по составу криозащитных растворов и скоростью замораживания клеточной взвеси. Основные характерные особенности данного типа криозащитных соединений - это жидкость, легко проникающая через мембраны клеток и способная к связыванию молекул вне- и внутриклеточной воды, со смещением точки замерзания раствора и препятствующая росту кристаллов льда внутри и снаружи клеток.
Известно, что стандартно используемые жидкостные криопротекторы: ДМСО, полиэтиленкрахмал, глицерин (А.С. № 1412039), пропиленгликоль, поливинилпирролидон, описанные в патентах (ЕА 009073 В1, RU 2283119, US 20050026133 A1) в недостаточной мере обеспечивают возложенные на них функции, в частности по защите клеточной культуры от образующихся при заморозке крупнокристаллических структур льда, которые, в конечном итоге, разрывают мембраны клеток или вытесняют последние в гиперосмотические каналы, где клетки подвергаются сильной механической деформации и воздействию повышенных концентраций растворенных веществ, что, в конечном итоге, является причиной денатурации белков мембранных элементов клеток, снижая жизнеспособность клеточных культур при криоконсервации.
В качестве ближайшего аналога заявляемого изобретения может рассматриваться RU 2303631 C1, опубл. 27.07.2007, раскрывающий способ криоконсервации МСК, с криопротектором ДМСО (5-10%), дополнительным недостатком которого является высокая токсичность ДМСО и его резкий запах, который может вызывать аллергию у работающего с ним персонала, что также ограничивает применение ДМСО в качестве криопротектора клеточных суспензий.
Известно также и применение под повышенным давлением в барокамере смеси инертных газов ксенона, криптона, аргона для криоконсервации органов и тканей животных в процессе низкотемпературной консервации (см. «Способ криоконсервации органов и тканей IN SITU» Патент РФ № 2268590 A01N 1/02. Опубл. 21.01.2006 Бюл. № 3).
В опытах, в частности, использовали смесь газов Kr, Ar, Xe в соотношении 2,5; 47,5; 5,0 об.% под давлением 1,5 атм для криоконсервации органов и тканей крысы in situ. В барокамеру помещали крысу массой порядка 300 г, интенсивно охлаждали ее проточной ледяной водой до 0°С с одновременным насыщением смесью инертных газов под давлением 1,5 атм для полного насыщения смесью газов тканей организма, затем вытесняли воду этой смесью. После чего крысу замораживали до -43°С и далее, снижая давление газовой среды, охлаждали до температуры жидкого азота и хранили в течение 6 часов. После разморозки из крысы извлекали сердце и пересаживали его реципиенту. Все функции сердца крысы-донора полностью сохранялись при пересадке крысе реципиенту.
Также близким к предлагаемому способу можно рассматривать способ консервации почки путем сочетания охлаждения при температуре (+2)-(+4)°С и гипербарии аргоном при давлении 1,5-2 атм (см. Шумаков В.И. и др. «Консервация органов» М., Медицина, 1975, с.127-128). Недостатком данного способа является сравнительно невысокая надежность и большая продолжительность ведения консервации, что можно объяснить недостаточно сниженным клеточным метаболизмом из-за применения температуры выше 0°С.
Однако использование таких сложных многоэтапных и многокомпонентных способов с применением смесей благородных газов для криоконсервации клеточных культур человека и этих технологий из доступных источников не известно.
Таким образом, используемые и известные жидкостные криопротекторы в известных концентрациях и известные смеси инертных газов, нагнетаемых под повышенным давлением для криоконсервации органов и тканей, обладают ограниченным криозащитным действием и, требуя для осуществления сложного оборудования (барокамеры, криокамеры) и больших затрат времени и средств, не позволяют нивелировать возможные побочные эффекты, возникновение которых может стать решающим при работе со стволовыми клетками человека, что сдерживает внедрение клеточных технологий в медицинскую практику.
Задачей изобретения является поиск криопротектора и разработка способа криоконсервации, обладающих минимальным повреждающим действием на клетки и клеточные суспензии, не имеющих токсических эффектов после разморозки и не требующих для применения специальной уникальной техники и оборудования при снижении затрат времени и средств на криоконсервацию мультипотентных мезенхимальных стромальных клеток (ММСК) человека, повышающих качество и жизнеспособность клеточных культур.
Задача решается тем, что в качестве криопротектора при криоконсервации смеси ММСК с культуральной средой используют химически чистый газ ксенон - Хе состава 99.999%, а криоконсервацию проводят путем продувки газом Хе до насыщения смеси клеточной культуры (суспензии ММСК) в среде DMEM (Sigma), помещенных в открытых пластиковых криопробирках, причем продувку Хе проводят при атмосферном давлении на ледяной бане при 0°С в течении 10-20 мин, после чего криопробирки объемом 2 мл со смесью ММСК насыщенной ксеноном закрывают и помещают в криоконтейнер, который погружают в морозильник типа Sanyo для контролируемого замораживания до -70-85°С со скоростью охлаждения 1°С в минуту и до образования монолита смеси культуральной среды с криопротектором Хе и далее для длительного хранения в хранилище с жидким азотом для последующего использования.
Основной компонент - криоконсервант заявляемого способа газ ксенон выпускается отечественной промышленностью, то есть предложение «промышленно применимо».
Ксенон - газ без цвета и запаха; (символ Хе - Xenonum) из группы благородных газов; плотность 5,85 кг/м3. Применяют Хе в газоразрядных лампах, а также в исследованиях и в медицинских целях (см. Политехнический словарь. Изд 3-е. М., «Советская энциклопедия», 1989, с.258).
В настоящее время газ ксенон, ввиду низкой токсичности, широко используются в анестезиологии в качестве наркотического средства и для терапии ряда заболеваний (см. Буров Е.Н., Потапов В.Н., Макеев Г.Н. Ксенон в анестезиологии. - Москва: «Пульс», 2000. - 389 с.).
Для проведения лабораторной практической проверки и исследования эффективности предложенного способа криоконсервации ксеноном ММСК в культуральной среде DMEM - мультипотентные мезенхимальные стромальные клетки (ММСК) были выделены из подкожной жировой клетчатки 4 здоровых мужчин в возрасте 27-42 г. и культивированы в условиях лаборатории в соответствии с регламентом.
После достижения 70% конфлюенции клетки были мобилизованы обработкой 0,25% раствором трипсина в ЭДТА (Invitrogen), пересажены на новые матрасы большей площади (на 4 матраса каждая) из расчета 1,000-3,000 кл/см2. Подсчет клеток производили на гематологическом анализаторе Cobas Micros ОТ.
В дальнейшем, по достижении конфлюенции 75-80%, культуры были случайным образом поделены на группы для проведения лабораторного опыта (таблица 1).
Для криоконсервации ММСК снимали с матрасов раствором трипсина-версена по стандартной методике и, после центрифугирования, ресуспендировали и подсчитывали на гематологическом анализаторе.
 |
|  |
| ||
Для обработки смеси культур клеток ксеноном (группа 4) открытые флаконы (пластиковые криопробирки) объемом 2 мл фирмы «Cryo.S» с культурой клеток в среде DMEM продували Хе в течение 10-20 минут при постепенном снижении температуры до 0°С на ледяной бане, после чего флаконы закупоривали, помещали в контейнер для контролируемого охлаждения Nalgene Cryo, а затем в холодильник Sanyo MDF - 192 при -84°С на 1 час. В последующем пробы (образцы) хранили в парах LNs при температуре минус 196°С в течение 48 часов и 6 месяцев. Данная схема обеспечивает равномерное падение температуры в диапазоне 0-84°С. Интенсивность охлаждения составляет 1°С/мин.
Для обработки клеток ДМСО (группы 2 и 3) готовили культуру клеток, содержащую двукратное количество клеток в половинном объеме среды и раствор предварительно стерилизованного фильтрацией ДМСО в культуральной среде с таким расчетом, чтобы при смешивании получить стандартное количество клеток в среде, содержащей 5 или 10% ДМСО.
Криопробирки объемом 2 мл с культурами, обработанными ДМСО, помещали в контейнер Nalgene Cryo и помещали в холодильник Sanyo MDF - 192 при минус 84°С на час, затем пробы хранили в парах LN2 при температуре минус 196°С. Образцы были поделены на группы и хранились 48 ч и 6 мес. соответственно.
Размораживание всех образцов проводили путем помещения криопробирки в водяную баню при 37°С. После разморозки проводилась оценка жизнеспособности клеточных культур по вариантам (группам), оценка их клоногенной активности, радиоизотопный метод. Так же после размораживания образцов исследовалась возможность спонтанной дифференцировки ММСК в четырех ортодоксальных направлениях (адипогенном, остеогенном, миогенном и хондрогенном).
Для удаления ДМСО клетки после размораживания перед посевом на культуральные среды неоднократно отмывали центрифугированием. С целью нивелирования возможных эффектов данной процедуры на изучаемые параметры, образцы, в которых в качестве криопротектора использовали ксенон, вводимый по предлагаемому способу, обрабатывали по такому же протоколу.
Жизнеспособность после проведения криоконсервации и размораживания клеток определяли по проценту окрашенных (0,4% раствором трипанового синего) в камере Горяева, одновременно оценивали пролиферативную активность клеток по включению в макромолекулы меченного селективного предшественника синтеза ДНК (214 C - тимидин Amersham Pharmacia Biotech). Радионуклид с активностью 37 КБк/мл среды вносили на 75 см2 матрасы одновременно с 0.5х106 клеток. Эксперимент прерывали через трое суток культивирования, клетки снимали с матрасов по стандартной методике и подсчитывали на гематологическом анализаторе. Подсчет радиоактивности производили в спирто-толуоловом сцинтилляторе на жидкостном сцинтилляционном счетчике Бета-2 (эффективность счета по углероду - 98%). Результаты выражали в беккерелях на 106 клеток.
Клоногенную активность исследовали после фиксации клеток, окраски и подсчета клеток, как отношение числа колоний, состоящих не менее чем из 20 клеток, к числу посеянных и выражали в процентах по отношению к контролю.
Полипотентность размороженных клеток изучали путем создания условий для дифференцировки ММСК в различных направлениях.
Для дифференцировки в адипогенном направлении в культуральную среду вносили комбинацию изобутилметилксантина, дексаметазона, инсулина и индометацина.
Для дифференцировки в хондрогенном направлении в культуральную среду вносили комбинацию инсулина, трансформирующего фактора роста и аскорбата.
Для дифференцировки в кардиомиогенном направлении в культуральную среду вносили рекомбинантные IL3 и IL6.
Для стимуляции дифференцировки в остеогенном направлении в культуральную среду вносили дигидровитамин D3, аскорбиновую кислоту и глицерофосфат.
Статистическая обработка проводилась с использованием пакета прикладных программ Statistica 3.04. Результаты считали достоверными р 0.05.
Результаты проведенных исследований представлены в таблице 2. В ходе исследований было подтверждено, что применение в качестве криопротектора ДМСО не обеспечивает полную сохранность клеток от повреждающего воздействия изменения температуры при криоконсервации и последующем размораживании (таблица 2) и приводит к снижению их клоногенной активности.
Так, доля дегенеративных клеточных форм после размораживания при использовании ДМСО была достоверно выше, чем в исходных культурах, причем при увеличении концентрации ДМСО с 5 до 10% продемонстрировало тенденцию к увеличению процента дегенеративных форм.
Однако в варианте опыта при применении в качестве криопротектора газа ксенона состава 99,999% по предложенному способу число дегенеративных клеточных форм практически не отличалось от начальных контрольных показателей, показывая высокую эффективность предложенного способа, а результаты изучения синтетических параметров клеток, при консервации которых в качестве протектора использовали ксенон, также не отличались от контрольных и полностью сохраняли все свои функции (таблица 2), при этом клоногенная активность в % была на 10-20% выше, чем в вариантах с ДМСО.
 |
|  |
| ||
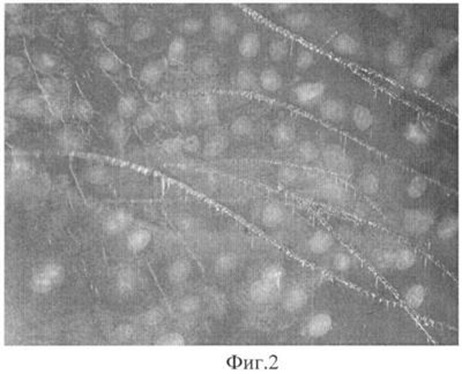
Результаты, полученные при исследованиях синтетической активности клеток после криоконсервации, подтверждают данные микроскопии. Так использование ДМСО с целью криопротекции сопровождается достоверным снижением синтетической активности в среднем на 14%. Полученные результаты согласуются с данными литературы и могут быть объяснены вытеснением клеток образующимися в среде крупными кристаллами льда в гиперосмолярные каналы (фиг.1), где клетки подвергаются воздействию механической деформации и осмотическому шоку.
На фиг.1 криопротектор ДМСО 10%, хранение 48 часов. На снимке хорошо просматриваются деформированные клетки ММСК, вытесненные кристаллами льда в гиперосмолярные каналы.
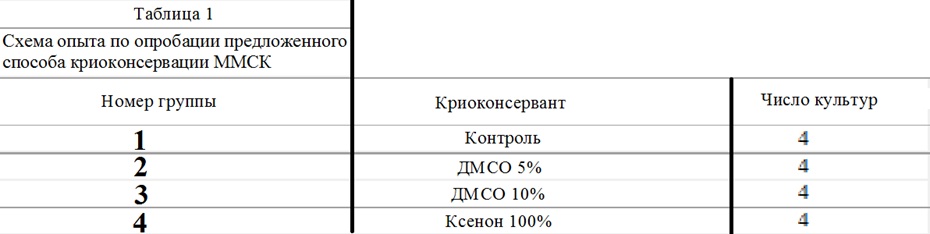
На фиг.2 криопротектор газ Хе 48 часов. Кристаллы льда визуально не определяются. Деформации клеток нет. Структура образца практически однородная.
Криопротектор ксенон, введенный по предложенному способу, образуя кластеры воды, препятствует образованию кристаллов льда как внутри клеток, так и в околоклеточной среде (фиг.2) - показывая уникальный неочевидный эффект равномерного замораживания объекта.
По-видимому, в этом случае повреждающее воздействие замораживания и оттаивания существенно ниже, нежели при использовании криопротектора ДМСО (варианты 2 и 3), что позволяет предположить, что газ ксенон, вводимый по предложенному способу в смесь ММСК в среде DMEM (Sigma) в течение 10-20 мин, более эффективен в качестве криопротектора, нежели стандартная методика с использованием ДМСО.
Однако многие криопротекторы, в том числе и ДМСО, обладают способностью вызывать нежелательную дифференцировку стволовых клеток, что приводит к снижению их полипотентности, формированию унипотентности. Последнее является существенным моментом, поскольку ставит вопрос о целесообразности криоконсервирования полипотентных клеток с использованием ДМСО.
С целью выяснения вопроса о наличии подобных эффектов у ксенона дополнительно была изучена способность криоконсервированных с использованием ксенона клеток в среде DMEM в качестве криопротектора ММСК дифференцироваться в 4 направлениях - хондрогенном, адипогенном, остеогенном, кардиомиогенном.
Следует отметить, что ни в одном случае не было отмечено каких-либо особенностей роста и дифференцировки криоконсервированных клеток по сравнению с интактными.
Так как в патентной и научно-технической литературе не известны подобные технические и технологические решения, аналогично заявляемому способу, то предложение полностью соответствует критерию изобретения «новизна».
Новизной предложенного способа криоконсервация ММСК является также использование известного препарата (газа ксенон), вводимого путем продувания до насыщения без давления в смесь (суспензию) ММСК в среде DMEM (Sigma) по новому назначению в качестве криопротектора при низкотемпературном замораживании с новым неочевидным эффектом в виде повышения качества ММСК после размораживания при сокращении затрат труда на осуществление способа и при высоком качестве криоконсервации, что подтверждается данными таблицы 2 и фиг.2.
Исследования применения газа ксенона в качестве эффективного криопротектора мультипотентных мезенхимальных стромальных клеток показали его значительные качественные преимущества перед стандартно используемым с этой целью ДМСО (5% и 10%).
Криопротектор ксенон состава 99,999%, вводимый по предложенному способу, в отличие от ДМСО, не вызывает нежелательной дифференцировки ММСК, и, наряду с этим, обеспечивает более высокую сохранность качества ММСК в ходе криопротекции и может быть рекомендован как перспективный криопротектор для мультипотентных мезенхимальных стромальных клеток человека, используемых в медицинской практике.
Формула изобретения
1. Способ криоконсервации мультипотентных мезенхимальных стромальных клеток (ММСК), включающий подготовку смеси культуры в культуральной среде, смешивание культуры клеток в культуральной среде с криопротектором, ступенчатое контролируемое охлаждение и замораживание смеси культуральной среды с криопротектором до температуры хранения и последующее хранение замороженной смеси при низких температурах, отличающийся тем, что в качестве криопротектора для насыщения смеси используют газ ксенон, вводимый до насыщения в подготовленную смесь клеточной культуры ММСК в среде DMEM, находящуюся в открытых криопробирках путем продувания культуральной среды ксеноном при 0°С с дальнейшим охлаждением и образованием первичного монолита культуральной среды с криопротектором, направляемым затем на замораживание до температуры хранения.
2. Способ криоконсервации мультипотентных мезенхимальных стромальных клеток по п.1, отличающийся тем, что для насыщения смеси в качестве криопротектора используют химически чистый газ ксенон состава 99,999%, а в качестве основы смеси культуральной среды ММСК используют среду DMEM (фирмы Sigma), помещенные в криопробирки объемом 2 мл, причем продувку ксеноном и первичное охлаждение смеси проводят в течение 10-20 мин при атмосферном давлении на ледяной бане с последующим закрытием и погружением насыщенных газом криопробирок в морозильник для контролируемого замораживания ступенчато до (-70)-(-85)°С при интенсивности охлаждения 1°С в минуту и далее для криохранения в хранилище с жидким азотом.
3. Способ криоконсервации мультипотентных мезенхимальных стромальных клеток по п.1, отличающийся тем, что для замораживания до (-70)-(-85)°С используют морозильник типа Sonyo, а для полного замораживания и криохранения криопробирок с замороженной культуральной смесью используют криохранилище с жидким азотом.
РИСУНКИ
 |

|  |
| ||
Рекомендуем ознакомиться и с недавно аарегистрированным патентом 2461331
Подробнее на сайтах: http://www.findpatent.ru/patent/243/2433173.html и http://elibrary.ru/item.asp?id=13599197
|
Макеев О.Г. Понамарев А.И. Коротков А.В. |
|
⇐ Перейти на главную страницу сайта |
⇑ Вернуться в начало страницы ⇑ |
Библиотека Ordo Deus ⇒ |
⇐ Каталог заглавий |
⇓ Полный свод знаний. Том первый А. ⇓ |
Каталог систематический ⇒ |
|
Внимание! Вы находитесь в библиотеке «Ordo Deus». Все книги в электронном варианте, содержащиеся в библиотеке «Ordo Deus», принадлежат их законным владельцам (авторам, переводчикам, издательствам). Все книги и статьи взяты из открытых источников и размещаются здесь только для чтения. |
|
Библиотека «Ordo Deus» не преследует никакой коммерческой выгоды. |
|
Все авторские права сохраняются за правообладателями. Если Вы являетесь автором данного документа и хотите дополнить его или изменить, уточнить реквизиты автора, опубликовать другие документы или возможно вы не желаете, чтобы какой-то из ваших материалов находился в библиотеке, пожалуйста, свяжитесь с нами по e-mail: |
Вас категорически не устраивает перспектива безвозвратно исчезнуть из этого мира? Вы не желаете закончить свой жизненный путь в виде омерзительной гниющей органической массы пожираемой копошащимися в ней могильными червями? Вы желаете вернувшись в молодость прожить ещё одну жизнь? Начать всё заново? Исправить совершённые ошибки? Осуществить несбывшиеся мечты? Перейдите по ссылке: «главная страница».
|
© Ordo Deus, 2010. При копировании ссылка на сайт http://www.ordodeus.ru обязательна. |

