Консервирование крови |
||
 |
 |
Оглавление
|
Консервирование кровиКонсервирование крови (лат. conservare хранить, сохранять) — методы хранения крови вне организма в состоянии ее биологической и функциональной полноценности. При консервировании кровь не утрачивает стерильности, жидкостных свойств в течение определенного срока, что позволяет заготавливать и применять ее для переливания с лечебной целью. Русский ученый В. В. Сутугин впервые в 1865 г. высказал идею консервирования крови с целью последующего использования ее при военной травме. В 1867 г. B. Раутенберг предложил предотвращать свертывание крови с помощью добавления углекислого натрия. Планомерное изучение проблемы консервирования крови в СССР началось в 1926 г. в Москве, в первом в мире Научно-исследовательском институте гематологии и переливания крови. Большой вклад в разработку этой проблемы внесли Д. Н. Беленький, C. И. Спасокукоцкий, А. А. Багдасаров, С. Д. Балаховский, А. Н.Филатов, С. Е. Северин, Ф. Р. Виноград-Финкель, П. М. Максимов и многие другие. В 30-х гг. для консервирования крови начали применять жидкость ЦИПК — 5% раствор цитрата для малого разведения (1:9) и глюкозоцитратный консервант ЦИПК № 1. К 1940 г. в СССР были разрешены основные задачи проблемы консервирования крови и установлена лечебная эффективность такой крови, что позволило широко внедрить в практику ее массовую заготовку. В период 1941 —1945 гг. были разработаны способы предотвращения бактериального загрязнения крови при ее массовой заготовке и хранении, а также новые консервирующие среды с лимоннокислым цитратом натрия и антисептиками. Это значительно повысило качество консервирования крови и снизило опасность гемотрансфузионных осложнений. В последующие годы продолжались теоретические и практические изыскания, направленные на удлинение сроков хранения крови при температурах выше и ниже 0° — в жидком и замороженном состоянии. Консервирование крови при температурах выше 0°Консервирование крови при температурах выше 0° проводится с целью: 1) стабилизировать кровь in vitro в жидком состоянии, то есть предохранить от свертывания, связывания или разрушения любого ее компонента; 2) сохранить функциональную активность и морфологическую, структуру клеток крови, позволяющие поддерживать на нормальном уровне или близком к нормальному обменные процессы в них и циркуляцию в кровеносной системе организма; 3) сохранить способность к приживаемости в организме реципиента после трансфузии; 4) сохранить кровь в стерильном состоянии. Наибольшее распространение как стабилизаторы получили лимонная кислота и лимоннокислый цитрат натрия. Механизм их действия состоит в связывании ионов кальция, что предотвращает свертывание крови. Динатриевая соль этилендиаминтетраацетата — ЭДTANa2 — также связывает ионы кальция. Однако одновременно она вызывает связывание ионов калия и магния и ранний гемолиз консервированной крови, что ограничило ее применение. Гепарин (50—60 мг на 1 л крови) используется для стабилизации крови главным образом в аппаратах искусственного кровообращения. Недостатком его является ограничение сроков стабилизации (до 24 часов) и образование сгустков за счет инактивации гепарина, в связи с чем он применяется лишь для кратковременного (несколько часов) консервирования крови. Стабилизация крови может быть достигнута и без добавления химических веществ — путем пропускания крови через колонку с катионообменными смолами. По этому принципу в Белорусском НИИ переливания крови Е. Д. Бугловым в 1969 г. разработан препарат М-1-фосфат целлюлозы. Для консервирования крови, кроме стабилизации, имеет значение сохранение морфологической целостности эритроцитов и их функциональной полноценности. Для этого требуется постоянный приток основного субстрата питания этих клеток — глюкозы, а также средств, обеспечиващих ее утилизацию,— ферментов и коферментов. Установлена прямая связь кислородно-транспортной функции эритроцитов с содержанием 2,3-дифосфоглицерата (2,3-ДФГ), его важная роль в регуляции сродства гемоглобина к кислороду и в процессе отдачи кислорода тканям: при низкой концентрации в эритроцитах 2,3-ДФГ сродство гемоглобина к кислороду повышено, при этом диссоциация оксигемоглобина и передача кислорода тканям затруднены; при высокой концентрации 2,3-ДФГ связи гемоглобина с кислородом ослаблены, оксигемоглобин диссоциирует быстрее и ткани легко извлекают кислород из его комплекса с гемоглобином. |
Известно, что АТФ, кроме участия в формировании 2,3-ДФГ, также может быть связана с гемоглобином и влиять на процесс отдачи кислорода тканям; поэтому предполагается корреляция кислородно-транспортной функции эритроцитов с содержанием 2,3-ДФГ и АТФ. Таким образом, наряду со стабилизацией, основное требование к гемоконсервантам — пополнять недостаток АТФ и 2,3-ДФГ. Введение в цитратный раствор для консервирования крови глюкозы дало возможность продления синтеза АТФ и покрытия потребности эритроцитов в энергии.
Кроме того, важным моментом явилось доведение рН консервирующих растворов до 4,5—5,1 (при этом эритроциты медленнее потребляют глюкозу), что отдаляет наступление гемолиза и повышает посттрансфузионную выживаемость эритроцитов.
Кислые глюкозоцитратные растворы начиная с 1947 г. получили признание во многих странах. Они позволяют сохранять консервированную кровь при t° 4—8° до 21 дня с посттрансфузионной выживаемостью 70% перелитых эритроцитов, что является международным стандартом. В СССР применяется раствор ЦОЛИПК-7б, ЛИПК-Л-6, в других странах — раствор ACD.
Состав консервирующего раствора ЦОЛИПК-7б: лимоннокислый цитрат натрия — 2 г, глюкоза — 3 г, левомицетин — 0,015 г, бидистиллированная вода до 100 мл. Срок хранения — до 2 лет.
Состав гемоконсервант ЛИПК-Л-6: лимоннокислый цитра натрия — 2,5 г, глюкоза — 3 г, натриясульфацил —-0,5 г, трипафлавин нейтральный — 0,025 г, бидистиллированная вода до 100 мл. Срок хранения—до 7-и дней.
Кислые глюкозоцитратные растворы стали основой для создания новы гемоконсервантов, например цитроглюкофосфата, содержащего 1 г лимонной кислоты, 0,75 г тринатрийфосфата 3 г глюкозы, до 100 мл бидистиллированной воды, нормального раствора едкого натра до рН 5,7 (20 мл р-ра на 80 мл крови), позволяющего удлинить сохранность функциональной полноценности эритроцитов. За рубежом применяется цитратно-фосфатный раствор с декстрозой — CPD.
Включение в гемоконсерванты метаболитов углеводно-фосфорного обмена (аденин, инозин, пируват и других) открыло новую перспективув консервирования крови — возможность восстановления («омоложения») консервированных эритроцитов после предельно допустимых сроков (21 день) хранения. Инкубация длительно хранившихся консервированных эритроцитов с метаболитами углеводно-фосфорного обмена приводит к восстановлению утраченной в процессехранения их функц. Полноценности (содержания 2,3-ДФГ, АТФ, Р50 и других показателей). Последующее замораживание восстановленных эритроцитов в жидком азоте позволяет сохранять «омоложенные» клетки длительное время.
Разработаны методы получения и консервирования компонентов крови: эритроцитной, тромбоцитной, лейкоцитной массы и плазмы. Консервирование клеток крови имеет большое значение, особенно в связи с возрастающим использованием в лечебной практике трансфузий отдельных компонентов вместо цельной крови.
Эритроцитная масса — наиболее распространенная трансфузионная среда. Получают ее путем асептического удаления плазмы после отстаивания или центрифугирования консервированной крови; в последующем возможно хранение концентрированной эритроцитной массы (гематокрит до 70%). В лечебной практике применяется также отмытая эритроцитная масса (подвергнутая повторному асептическому отмыванию физиологическим раствором), особенно у реактивных больных (сенсибилизированных, аллергизированных и других).
Для применения в клин, практике лейкоцитной и тромбоцитной масс разработаны методы их получения с использованием центрифугирования в пластикатной аппаратуре и коллоидных осадителей. Лейкоцитная масса сохраняется до 24 часов.
Тромбоцитная масса сохраняется в собственной плазме при t° 4° в течение 6—8 часов, а при t° 22° в пластикатных мешках — 72 часа.
Выделение и хранение лейкоцитной и тромбоцитной масс, кроме пластикатной аппаратуры, осуществляют с помощью специальных фракционаторов для автоматического асептического разделения крови на компоненты и получения в больших количествах этих клеток от одного донора методом цитафореза.
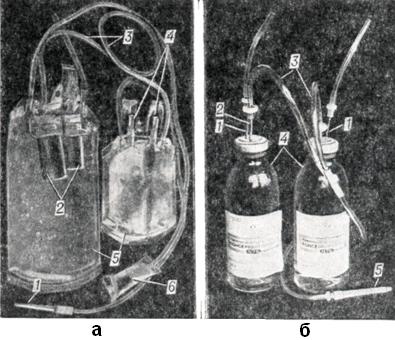
Массовую заготовку консервированной крови и ее компонентов проводят учреждения службы крови (станции и отделения переливания крови) по единым методическим правилам. Кровь консервируется главным образом на стерильных гемоконсервантах 76 и цитроглюкофосфате, изготовляемых на заводах. Взятие Крови от доноров в стеклянные флаконы или пластикатные мешки с гемоконсервантом производится в стационарных операционных станций и отделений переливания крови или по месту работы доноров, куда направляются специальные бригады, оснащенные всем необходимым для заготовки крови. Стерильность консервированной крови обеспечивается соблюдением строгих мер асептики при ее заготовке от доноров, использованием иростерилизованных гемоконсервантов (в герметически укупоренных флаконах или пластикатных мешках) и замкнутых стерильных систем для взятия крови (рис. 1). Стерильность и качество консервированной крови строго контролируют путем выборочных бактериологических посевов, производимых на станциях и в отделениях переливания крови, а также макроскопической оценкой в лечебных учреждениях перед выдачей для трансфузии.
Консервирование крови при температурах ниже 0°.
Долгосрочное хранение клеток крови и плазмы возможно лишь при отрицательных температурах. При этом клетки сохраняются в анабиотическом состоянии — при подавлении метаболизма, но сохранении активности ферментных систем и жизнеспособности клеток.
Замораживание и хранение плазмы производят при t° —30°. Решению проблемы замораживания эритроцитов помогло установление факта, что ультрабыстрое охлаждение крови (100° в секунду) может происходить почти без кристаллического затвердевания (в тонком слое удавалось заморозить и сохранить малые объемы эритроцитов), и открытие криозащитного свойства глицерина, позволившего при смешении с эритроцитами сохранять их в замороженном состоянии. А. Д. Беляков с соавторами в 1956 г. и Ф. Р. Виноград-Финкель с соавторами в 1958 г. разработали метод сохранения клеточных элементов крови в переохлажденном состоянии при температурах ниже 0° (от —8 до —16°) без кристаллообразования.
В практике применяют два метода криоконсервирования эритроцитов: ультрабыстрое замораживание в жидком азоте (—196°) с малыми (15 %) концентрациями глицерина или медленное замораживание с большой (30—50%) концентрацией глицерина при умеренных температурах (—40, —80°) в воздушной камере электрорефрижераторов. Эти методы позволяют длительно (годами) сохранять неповрежденными 85—95% эритроцитов.
Методика ультрабыстрого замораживания эритроцитной массы состоит в том, что из цельной донорской крови после центрифугирования эритроциты выделяют с соблюдением строгих условий асептики и смешивают их со стерильным ограждающим раствором, содержащим глицерин. Смесь переводят в алюминиевый гофрированный контейнер или специальный пластикатныи мешок и подвергают в течение 2 минут замораживанию путем погружения в ванну с жидким азотом, после чего переносят в специальный бункер или камеру также с жидким азотом для последующего длительного хранения. Для использования замороженных эритроцитов контейнеры или мешки вынимают из жидкоазотного хранилища, подвергают оттаиванию путем помещения на 25 сек. в ванну с водой (t° 45°). После оттаивания производят отмывание эритроцитов от глицерина маннитно-со левыми, глюкозоманнитными, солевыми и другими растворами с последовательно снижающейся гиперосмией до изоосмии. Для отмывания эритроцитов используют метод последовательного центрифугирования и сливания надстоя или автоматические фракционаторы различного типа для асептического отмывания размороженных эритроцитов в замкнутой системе. Отмытые эритроциты заливают равным объемом изотонических растворов (сахарозоглюкозофосфатный, солевой и другие), после чего они пригодны для переливания в течение 24 часов.
Методика медленного замораживания при умеренных температурах имеет свои преимущества — не требуется жидкоазотного оборудования, так как используются электрорефрижераторы. В качестве эндоцеллюлярного криофилактика широко применяют глицерин в большой концентрации (40%), хотя это и усложняет способы его отмывания после размораживания эритроцитов.
Для криоконсервирования лейкоцитов и тромбоцитов подобраны ограждающие растворы, содержащие криофилактики эндоцеллюлярного (глицерин, диметилсульфоксид, диме-тилацетамид) или экзоцеллюлярного действия (поливинилпирролидон) в сочетании с углеводными растворами (сахароза, глюкоза, аскорбиновая кислота). Замораживание клеток производят в специально сконструированных аппаратах, позволяющих охлаждать их по заданной программе. После программного замораживания и оттаивания лейкоцитов можно получать от 75 до 92% восстановленных клеток.
Существует метод разделения лейкоцитной массы на лимфоциты и гранулоциты. Размороженные лимфоциты предназначаются для типирования и переливания больным с угнетенной иммунологической активностью; гранулоциты можно использовать при лечении больных с септицемиями, агранулоцитозом и другим.
Замораживание, хранение, оттаивание и отмывание эритроцитов и других клеток крови производятся в специально организованных отделениях (банках) долгосрочного хранения замороженной крови при учреждениях службы крови (рис. 2).
 |
 |
 |
Рис. 2. | ||
Клинический, опыт подтверждает эффективность трансфузий взвеси размороженных эритроцитов при лечении острой кровопотери, анемий различной этиологии, при операциях на открытом сердце и при использовании аппарата «искусственная почка». Преимущества трансфузий размороженных отмытых эритроцитов заключаются в их лучшей переносимости (без посттрансфузионных реакций) больными, сенсибилизированными или аллергизированными предыдущими переливаниями крови или медикаментозными средствами. Они не содержат иммуноагрессивных клеточных (лейкоциты и тромбоциты) и белковых компонентов плазмы, являющихся основной причиной реакций при повторных трансфузиях.
Метод криоконсервирования крови, помимо обеспечения многолетнего хранения, создания запасов крови редких групп, снижает риск заражения вирусным гепатитом В. Он также дает возможность широкого применения аутотрансфузий путем предварительного накопления крови от данного больного и длительного ее хранения в замороженном состоянии до момента операции или необходимости трансфузий.
Посмертная кровь
Идея заготовки и применения посмертной (трупной, постагональной, фибринолизной) крови была высказана и экспериментально обоснована B. Н. Шамовым в 1929 г., который доказал, что кровь трупов животныхв первые 6 — 8 часов после смерти сохраняет свою полноценность, не имеет токсических свойств и оказывает лечебный эффект при переливанииобескровленным собакам. В 1930 г. C. С. Юдин впервые с успехом произвел переливание посмертной крови больному с острой кровопотерей. Дальнейшие многолетние исследования ряда авторов послужили основанием для заключения о сохранности функциональной полноценности посмертной крови, ее не токсичности и выраженной лечебной эффективности для человека.
Особым качеством посмертной крови является ее способность после заготовки свертываться, а затем «развертываться», то есть сгусток вновь переходит в жидкое состояние. Это свойство, названное фибринолизом, — сложный биологический процесс, происходящий в системе свертывания крови после смерти. Оно используется с диагностической целью: фибринолиз характерен только для крови скоропостижно скончавшихся людей и не наблюдается в случаях смерти после длительной агонии. Фибринолиз позволяет заготавливать и хранить кровь без добавления стабилизирующих средств. В СССР в Московском городском НИИ скорой помощи им. Н. В. Склифосовского и Ленинградском городском НИИ скорой помощи им. проф. Ю. Ю. Джанелидзе накоплен большой опыт заготовки и применения посмертной крови. В ряде городов организованы специальные отделения для заготовки от трупов органов и тканей, в том числе крови. Существуют определенные правила взятия крови (в первые 6—8 часов после смерти) от внезапно умерших в результате острой сердечно-сосудистой недостаточности, спазма или склероза коронарных сосудов, инфаркта миокарда, гипертонической болезни, кровоизлияния в мозг, электротравмы, закрытой травмы черепа, спинного мозга, шейного отдела позвоночника, асфиксии от сдавления. Установлена возможность удлинения сроков хранения посмертной крови путем добавления специальных консервирующих растворов (сахарозоглюкозофосфатного).
Использование посмертной крови, хранившейся при температуре 4—6°, разрешается после получения результатов лабораторного исследования крови и судебно-медицинского вскрытия трупа. По данным К. С. Симоняна с соавторами (1975), ок. 24% заготовленной крови бракуется: 7% по бактериальному загрязнению, 13% по серологическим показателям и примерно 4% на основании противопоказаний по данным патологоанатомического исследования.
Переливание посмертной крови не получило широкого распространения в лечебной практике главным образом в связи с хорошей организацией донорства и службы крови, обеспечивающей лечебные учреждения консервированной кровью.
Смотри также Консервирование органов и тканей.
|
Аграненко В.А. |

|
⇐ Перейти на главную страницу сайта |
⇑ Вернуться в начало страницы ⇑ |
Библиотека Ordo Deus ⇒ |
⇐ Консервирование пищевых продуктов |
⇓ Каталог систематический ⇓ |
Консервирование органов и тканей ⇒ |
|
Все статьи в полном изложении, Вы можете найти в большой медицинской энциклопедии — Главный редактор: академик АН СССР (РАН) и АМН СССР (РАМН) Б.В. Петровский. — Москва издательство «Советская энциклопедия» 1989г. |
|
Внимание! Вы находитесь в библиотеке «Ordo Deus». Все книги в электронном варианте, содержащиеся в библиотеке «Ordo Deus», принадлежат их законным владельцам (авторам, переводчикам, издательствам). Все книги и статьи взяты из открытых источников и размещаются здесь только для чтения. |
|
Библиотека «Ordo Deus» не преследует никакой коммерческой выгоды. |
|
Все авторские права сохраняются за правообладателями. Если Вы являетесь автором данного документа и хотите дополнить его или изменить, уточнить реквизиты автора, опубликовать другие документы или возможно вы не желаете, чтобы какой-то из ваших материалов находился в библиотеке, пожалуйста, свяжитесь с нами по e-mail: |
Вас категорически не устраивает перспектива безвозвратно исчезнуть из этого мира? Вы желаете прожить ещё одну жизнь? Начать всё заново? Исправить ошибки этой жизни? Осуществить несбывшиеся мечты? Перейдите по ссылке: «главная страница».
|
© Ordo Deus, 2010. При копировании ссылка на сайт http://www.ordodeus.ru обязательна. |