Структура водных растворов белков в присутствии клатратов ксенона |
||
 |
 |
Оглавление
|
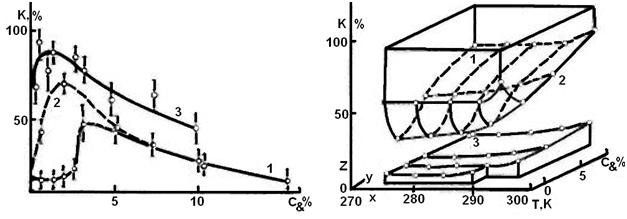
Структура водных растворов белков в присутствии клатратов ксенонаИзвестно, что сохранение жизнеспособности организмов достигается путем перевода их в состояние обратимого анабиоза с помощью процессов замораживания, высушивания или осмотического обезвоживания. В криобиологических исследованиях, связанных с изучением процессов замораживания—оттаивания клеточных структур, возникает ряд проблем, обусловленных губительным влиянием обезвоживания на структурную целостность и функциональную активность клеточных компонентов (мембран, ДНК, белков-ферментов и так далее). В связи с этим необходим поиск новых методов обезвоживания или связывания молекул воды. Одним из эффективных, но малоизученных в плане биологических применений способов снижения подвижности молекул воды в растворах и суспензиях является образование клатратов. В качестве клатратообразующих веществ наибольший интерес представляют инертные газы, так как в первом приближении они не оказывают токсического действия на биологические системы и химически инертны по отношению к компонентам раствора. Клатраты инертных газов, в частности ксенона, образуются при положительных температурах и сравнительно невысоких давлениях. В растворе происходят явления, во многом сходные с процессами, наблюдаемыми при замораживании: появляется твердая фаза, а растворенные вещества вытесняются в жидкую, при этом подвижность молекул воды снижается. В то же время структура и физические свойства клатратных кристаллов и льда существенно различаются. Это указывает на то, что действие клатратов на биологические структуры может быть совсем иным, чем льда при замораживании. В настоящей статье поставлена задача исследования особенностей образования клатратов ксенона в растворах белков, определения влияния природы белка на стабильность клатратов и изучения изменения подвижности молекул приклатратообразоваиии. Методика исследования. В работе использовали ксенон высокой чистоты (ГОСТ 10219—77), яичный альбумин (ЯА), фирмы «Реанал», сывороточный альбумин быка (САБ) фирмы ICN, рибонуклеазу А фирмы SIGMA без дополнительной очистки. Растворы белков готовили в бидистиллированной и тяжелой воде D2О с изотопным обогащением 99,8 %. Для удаления растворённых газов растворы белков перед использованием продували ксеноном. Получение клатратов ксенона и их регистрирование проводили по методике, данной в работе [5]. Измерение ЯМР-параметров протонов образцов проводили на частотах резонанса f = 20 и 90 МГц. Время продольной релаксации Т1 определяли с помощью импульсной последовательности 90°- τ-90°, а время поперечной релаксации Т2 — с помощью последовательности 90°- τ—180°- τ-эхо. В некоторых экспериментах величину T2 устанавливали с помощью серии Карра—Парселла—Мейбума—Гилла (КПМГ). Коэффициент самодиффузии D измеряли методом постоянного градиента магнитного поля [5]. Температура образцов поддерживалась с точностью 1°С. Результаты и bх обсуждение. На кривых 1—3 (рис. 1) в области малых концентраций (0,5—4 %) показаны максимумы, положение и величина которых несколько различаются для разных белков. Согласно Полннгу, молекулы воды вблизи некоторых боковых групп молекул белков могут быть стабилизированы в структурах, близких к структуре клатратов. Позднее подчеркивалось, что неполярные группы и гидрофобные участки поверхности молекул белков могут являться зародышами образования клатратоподобных структур. На основании этих данных можно предположить, что процесс образования клатратов ксенона в водных растворах белков начинается в районе неполярных участков белковых молекул. В зонах гидрофобных участков поверхности молекул белков могут образовываться клатраты ксенона в виде небольших доменов, слияние которых приводит затем к образованию более крупных кристаллов клатратов. По-видимому, этот процесс агрегирования доменов и роста количества клатратов определяется количеством белка в растворе. При небольшом повышении концентрации белка число гидрофобных участков возрастает; значит, увеличиваются количество клатратных доменов и общее количество клатратов в растворе. Однако когда белка много и значительное количество воды будет израсходовано на гидратацию белка связыванием водородными связями с полярными участками биомакромолекул, процесс образования клатратов будет затруднен и количество образующихся клатратов уменьшится. |
На рис. 1 видно, что существенное снижение количества клатратов происходит уже с концентрации белка 7—10%. Возможно, что соотношение числа полярных и неполярных групп на поверхности белковых молекул определяет положение и величину максимумов для трех исследованных растворов белков.
При исследовании процесса продольной релаксации протонов в водных растворах ЯА с клатратами ксенона был обнаружен неэкспоненциальный характер восстановления продольной намагниченности, для которой выделены две компоненты времени спинрешеточной релаксации Т1. В диапазоне температур 275—290° К время релаксации медленной компоненты при частоте резонанса 20 МГц равнялось 300— 400 мс, а быстрой — 20—40 мс. На рис. 2 по оси х обозначена температура, по оси у — концентрация альбумина, по оси z — относительная доля воды в разных фазах, определенная методом ЯМР. Диаграмма получена по данным ЯМР следующим образом. Долю фазы 1, соответствующую воде в твердых клатратных структурах, определяли по методике работы [5]. Количественное соотношение фаз 2 и 3 вычисляли по амплитудам медленной и быстрой компонент времени продольной релаксации Т1.
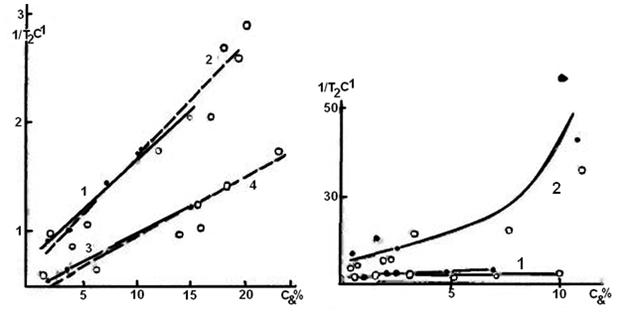
Для водных растворов САБ с клатратамн ксенона спад сигнала спинового эха на частоте резонанса 20 МГц разлагался на две экспоненциальные кривые, характеризующиеся медленным и быстрым временем поперечной релаксации T2. Быстрая компонента в исследованном интервале концентраций белка 0—10 % составляла 0,5—2 мс, а медленная изменялась от 10 до 100 мс в зависимости от количества клатратов и была снижена по сравнению с ее величиной в растворе без клатратов (300—900 мс). Кроме того, при образовании клатратов в растворах САБ снижалась и величина Т1 протонов водной компоненты. Когда в растворе белка образуются клатраты ксенона, количество жидкой воды уменьшается. В результате возрастает концентрация (белка относительно жидкой фазы и монотонно растет скорость продольной релаксации протонов воды в растворах САБ с клатратами ксенона (рис. 3). На рис. 3 видно, что ход зависимости роста скорости продольной релаксации 1⁄Т1 Для растворов САБ с клатратамн ксенона повторяет концентрационную зависимость 1⁄Т1 для растворов без клатратов. Такое поведение говорит о том, что на образование клатратов идет свободная вода, а подвижность оставшейся жидкой воды снижается. Об уменьшении подвижности воды при образовании клатратов свидетельствует также поведение величин энергий активации Eа движений молекул воды, определенных по линейным участкам зависимости ln Т1 для растворов ЯА с клатратами ксенона. При температурах 275—287° К в растворах ЯА величина Еа была близка к значению для чистой воды и составляла 16,8 кДж⁄моль. При образовании клатратов ксенона величина Еа возрастала в пределах 20,9—22,6 кДж⁄моль.
По сравнению с поведением l/T1 (см. рис. 3) характер поведения зависимости скорости поперечной релаксации 1/Т2 протонов воды от концентрации белка в жидкой фазе образцов с клатратами отличается от аналогичной зависимости в растворах без клатратов (рис. 4). При анализе этих кривых можно заметить, что при образовании клатратов на Т2, кроме уменьшения количества свободной воды, возможно, влияет еще ряд факторов, в частности гетерогенность образцов. Поскольку наличие области клатратов с жесткой решеткой из молекул воды должны приводить к появлению магнитной неоднородности образцов, можно предположить, что это повлияет на измеряемую величину Т2. Известно, что применение последовательности КПМГ при измерении Т2 в гетерогенных системах позволяет однозначно выделить вклад в релаксационный распад ядерной намагниченности, обусловленный диффузией частиц в неоднородном магнитном поле, и оценить величину неоднородности поля в объеме образца [2]. Однако исследование скорости поперечной релаксации 1/Т2 от времени разделения импульсов τ в последовательности КПМГ для водных растворов САБ с клатратами ксенона и без них показало, что клатратные неоднородности, по крайней мере с размерами х≥0,1 — 1 мкм, не могут определять поведение 1/Т2 - В то же время вполне возможна мелкодисперсная структура образцов с клатратами характерных размеров — менее 0,1 мкм. Дисперсные частицы связывают свободную воду и влияют на измеряемую величину Т2. Повидимому, при повышении количества клатратов мелкие кристаллы могут сливаться в большие клатратные домены. При этом увеличиваются структурные препятствия для движения молекул жидкости, из-за чего измеряемый коэффициент самодиффузии Д при 40—50 % клатратов в растворе САБ снижается на порядок по сравнению с величиной Дводы (Д≅0.085Дводы).
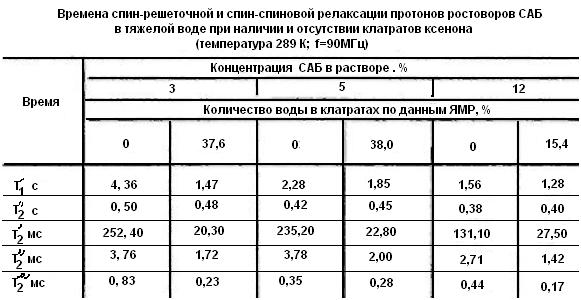
Другим фактором, определяющим поведение 1/Т2 (см. рис. 4), может быть снижение подвижности белковых молекул при образовании клатратов ксенона. Для проверки этого предположения были исследованы продольная и поперечная релаксации протонов в растворах САБ в тяжелой воде при наличии и отсутствии клатратов ксенона на частоте резонанса 90 МГц. В исследованных образцах кривая восстановления продольной намагниченности разлагалась на две компоненты с временами релаксации Т′1 и Т″1 (от протонов белка Т″1 и протонов НДО Т′1), в то время как спад сигнала спинового эха разлагался на три экспоненциальные кривые, характеризующиеся временами спин-спиновой релаксации Т′2, Т″2 и Т″1 (две компоненты от протонов белка и одна — от протонов воды).
Отнесение компонент Т1 и Т2 к протонам молекул воды НДО и белка производилось путем сравнения зависимостей амплитуд этих компонент от концентрации белка и H2O в растворе. Значения величин указанных выше компонент представлены в таблице. Величины Т′1 и Т′2 водной компоненты при образовании клатратов заметно уменьшались с повышением концентрации белка и количества клатратов ксенона. Такое поведение еще раз подтверждает снижение подвижности молекул воды. Времена компонент Т″2 — от протонов бо¬ковых групп молекул белка — и Т″2 — от протонов подвижных частей белковой глобулы и их амплитуды при образовании клатратов несколько уменьшаются. Это говорит прежде всего о том, что замедляются вращательные движения боковых групп молекул белка и подвижность белковых глобул в целом. Повидимому, происходит это частично из-за чисто стерических эффектов присутствия клатратов ксенона, а также из-за жесткой связи клатратов с гидрофобными участками молекул белков. В то же время величина компоненты времени продольной релаксации Т″1 протонов молекул белка не изменяется при образовании клатратов ксенона. Такое поведение свидетельствует о том, что даже при снижении подвижности белковых молекул в объеме всего раствора внутренние движения глобул, за которые ответственна компонента Т″1, сохраняются. Поскольку молекула сывороточного альбумина имеет доменную структуру, такими внутренними движениями могут быть колебания доменов белковой глобулы относительно одна другой.
На основании изложенных результатов можно сделать выводы.
Метод ЯМР-релаксации применим для определения доли воды, входящей в твердые клатратные структуры в растворах белков. На основе данных этого метода построена фазовая диаграмма состояния воды в растворе белка с клатратами ксенона.
 |
 |
 |
Получена зависимость количества образующихся клатратов от концентрации белка в растворе, выявлен максимум в диапазоне концентраций белка 0,5—4 % и обнаружена зависимость его величины и положения от природы белка. Высказано предположение, что это явление обусловлено соотношением полярных и неполярных групп на поверхности молекул белков.
Показано, что наличие «барьеров» и структурных препятствий, возникающих при образовании клатратов ксенона, существенно снижает измеряемый коэффициент самодиффузии молекул воды в растворах белка. В действительности трансляционная подвижность молекул воды в жидкой фазе, повидимому, снижается в значительно меньшей степени.
Из данных ЯМР-релаксации следует, что при образовании клатратов ксенона, как и при медленном замораживании растворов, происходит вытеснение молекул белка в объем жидкой воды.
Анализ зависимостей скоростей релаксации Т1 и Т2 от количества белка в жидкой фазе растворов САБ с клатратами показал, что в образовании клатратов принимает участие в основном свободная вода, при этом снижается подвижность не только молекул воды, но и молекул белка.
Литература
1.Бык С.Ш., Макогон Ю.Ф., Фомина В.И. Газовые гидраты. — М: Химия. 1980. 296 с.
2.Волков В.Я., Даутов Р.А„ Непримеров И.Н. Стимулированное эхо н трансляционное движение ядер в гетерогенных системах. — В кн.: Радиоспектроскопия. Пермь, 1980, с. 189-193.
3.Голдовский А.М. О состоянии организмов на стадиях анабиоза. — Криобиология и криомедицина. 1980. вып. 7, с. 6 - 10.
4.Родин В.В., Архангельский А.И., Исаьгалин Ф.Ш., Волков В.Я. Исследование гидратов ксенона в водных растворах белков методом ЯМР-релаксации. — В кн.: Тез. докл. Всесоюз. симпоз. «Магнит. резонанс в биологии и медицине». М.; Черноголовка. 1981, с. 115—116.
5.Фаррар Т., Беккер Э. Импульсная и Фурье-спектроскопия ЯМР. — М.: Мир, 1973.— 164 с.
|
Волков В.Я., Исангалин Ф.Ш., Родин В.В. |

|
|
Внимание! Вы находитесь в библиотеке «Ordo Deus». Все книги в электронном варианте, содержащиеся в библиотеке «Ordo Deus», принадлежат их законным владельцам (авторам, переводчикам, издательствам). Все книги и статьи взяты из открытых источников и размещаются здесь только для чтения. |
|
Библиотека «Ordo Deus» не преследует никакой коммерческой выгоды. |
|
Все авторские права сохраняются за правообладателями. Если Вы являетесь автором данного документа и хотите дополнить его или изменить, уточнить реквизиты автора, опубликовать другие документы или возможно вы не желаете, чтобы какой-то из ваших материалов находился в библиотеке, пожалуйста, свяжитесь с нами по e-mail: |
Вас категорически не устраивает перспектива безвозвратно исчезнуть из этого мира? Вы желаете прожить ещё одну жизнь? Начать всё заново? Исправить ошибки этой жизни? Осуществить несбывшиеся мечты? Перейдите по ссылке: «главная страница».
|
© Ordo Deus, 2010. При копировании ссылка на сайт http://www.ordodeus.ru обязательна. |