Влияние ксенона на систему ДНК-связанная вода по данным метода импульсного ЯМР |
||
 |
 |
Оглавление
|
Влияние ксенона на систему ДНК-связанная вода
|
|
Родин В.В., Новиков И.А., Волков В.Я. |
Методом импульсного ЯМР изучено влияние инертного газа ксенона на характер перестроек в гидрзтнон оболочке ДНК при Т < 273° К в интервале относительной влажности 80—100%.
Известно, что вода играет важную роль в формировании и стабилизации структуры таких биополимеров, как ДНК, РНК и белки. От состояния гидратной оболочки лиофнлизированной ДНК зависит устойчивость ДНК-содержащих биопрепаратов при некоторых экстремальных воздействиях (5). Поэтому возникает необходимость исследования на молекулярном уровне механизма возможных структурных перестроек в системе ДНК-связанная вода и поиска различных условий и факторов, влияющих на эти перестройки.
По данным литературы (3, 5). препараты лиофилизированнойн ДНК при относительной влажности свыше 70—80% в области температур менее 273° К° претерпевают два структурных перехода, один из которых обусловлен вымерзанием воды, тогда как другой, происходящий при более высоких температурах (258—268° К°), не связан с переходом воды в лед. Эти переходы обнаружены по температурным зависемостям времени корреляции вращения спинового зонда (5) и изучены методами ЯМР (3). При подборе веществ, влияющих на структурные переходы в данной системе, выбор падает на соединения, которые производят наименьшее химическое воздействие на макромолекулы самого биополимера. В этой связи представляется возможным использовать инертный газ ксенон (оказывающий при определенных условиях сильное влияние на структуру воды (1,6)), который в растворах биополимеров и клеточных суспензиях уже был апробирован нами ранее (4). В данной работе методом импульсного ЯМР исследовался механизм влияния ксенона на препараты лиофилизированиой ДНК с относительной влажностью 75—100%.
В работе использовались лиофилыю высушенные препараты натриевой соли тимусной ДНК, выдержанные в парах насыщенных растворов солей с относительной влажностью 75—100%. ДНК в этих условиях имеет выскоупорядоченную структуру двойной спирали (5). Лиофильно сухие препараты помещались в специальные пирексные ампулы, после чего образцы насыщали водой в эксикаторах с соответствующей относительной влажностью, закрывали герметическими крыш¬ками и использовали в последующих ЯМР-экспернментах.
Экспериментальные данные получали на основе анализа амплитуды сигнала свободной индукции (ССИ) (ССИ протонов после 90°-го импульса и времени спин-спиновой релаксации Т2 протонов воды и протонов ДНК). Время спин-спиновой релаксации протонов воды определяли на частоте резонанса 90 МГц с помощью серии Карра-Парселла-Майбума-Гилла. Для протонов ДНК время спин-спиновой релаксации измеряли по спаду ССИ. Анализ спада ССИ, имеющего двухкомпонентный характер, показал, что медленная компонента (Т2 ∼ 2—10 мс) относится к протонам воды, а быстрая — (Т2 ∼ 15—20 мкс) — к протонам ДНК. По уменьшению амплитуды медленной компоненты ЯМР-сигнала при охлаждении рассчитывали содержание незамерзшей воды (с учетом известной массы образца, массы нуклеотида и соответствия ЯМР-сигнала водных протонов количеству воды в образце).
Обработку препаратов ДНК ксеноном проводили статическим методом (4), для чего ампулы с образцами выдерживали под давлением этого газа 0,8—1,2 МПа при 278° К°. В этих условиях образовывались льдоподобные структуры клатратов ксенона, количество которых, как и ранее, оценивали по уменьшению ССИ протонов воды (4). Процесс клатратообразования инициировали путем встряхивания ампул и кратковременного их охлаждения сухим льдом. Температуру образцов поддерживали с точностью 1° К°.
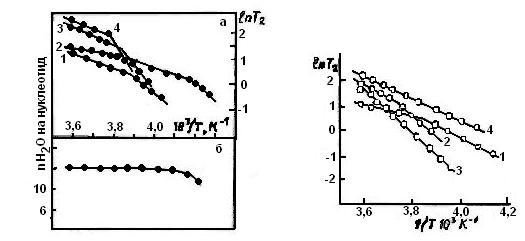
Данные ЯМР-исследованнй структурных переходов в системе ДНК-связанная вода (зависимости логарифмов времени спин-спиновой релаксации протонов воды от обратной температуры (3.5)) были воспроизведены на используемых в настоящей работе препаратах ДНК и представлены на рис. 1. На этом же рисунке приведена зависимость содержания незамерзшей воды в гидратной оболочке ДНК при 86% относительной влажности от температуры с целью сопоставления ее поведения при одних и тех же температурах с динамическими характеристиками водной фазы данной системы.
На кривых ln T2 (рис. 1) отчетливо видны изломы, которые характеризуют резкое уменьшение подвижности водных протонов с понижением температуры и не связаны с замерзанием воды. Образование льда в данных препаратах ДНК с относительной влажностью ∼ 86% не происходит вплоть до 234° К°. Указанные выше перегибы в зависимостях ln Т2 от 1/Т связываются в литературе с конформационными перестройками в структуре гидратнон поверхности ДНК и самой молекулы биополимера (3,5).
Увеличение исходной влажности препаратов ДНК приводило к повышению температуры наблюдаемого перехода (рис. 1, кривые 3, 4), а при высоком содержании воды — и к совпадению ее величины с температурой фазового перехода вода-лед.
При обработке ксеноном этих же препаратов ДНК наблюдались характерные изменения положения точек перегибов в зависимостях ln Т2 от 1/Т (рис. 2). Из рисунка видно, что излом указанной зависимости в области 258—266° К° в присутствии ксенона сдвигается в область повышения температур либо совсем исчезает при повышении исходной влажности препаратов. Представленные на этом рисунке данные свидетельствуют также о том, что ксенон начинает изменять гидратную оболочку ДНК при относительной влажности ≥ 86%. При относительной влажности ≥93% большинство молекул воды переходит в твердую фазу клатратов ксенона уже при 270—281° К° в результате этого при температурах менее 273° К° отсутствует переход без вымерзания воды. По-видимому, процесс клатратообразования аналогичен структурному переходу, связанному с вымерзанием воды в системе ДНК-связанная вода в отсутствие данного газа при более низких температурах.
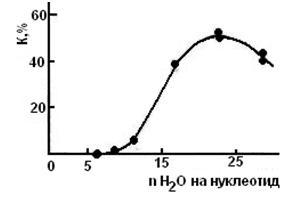
На рис. 3 представлена зависимость количества образующихся клатратов ксенона от исходной влажности образцов ДНК которая указывает на особый характер связывания водных молекул в матрице двойной спирали ДНК. При малом содержании воды в препаратах ДНК (8—9 молекул Н2О на нуклеотнд) водные молекулы достаточно жестко соединены с сахаро-фосфатным остовом и азотистыми основаниями (, и ксенон не может конкурировать с молекулами воды при постройке клатратных ячеек. При влажности препаратов свыше 11—12 молекул Н2О на нуклеотнд (когда начинает появляться второй и последующий монослои водных молекул) происходит набухание матрицы ДНК и появление более слабосвязанных молекул воды. В этих условиях оказывается возможным образование структур клатратоподобного типа в связи с вероятным стабилизирующим влиянием азотистых оснований на структуру воды. Известно, что клатратные структуры с большим количеством содержащихся в них водных молекул образуются такими гидрофобными веществами, как благородные газы, метан, хлор и другие (1, 6). Однако по такому же клатратному тину связывают воду (но только в меньшем количестве) вещества, молекулы которых выступают донорами и акцепторами водородных связей. Соединения, содержащие аминогруппы, могут образовывать водные клатраты не только помещением свиих молекул (или отдельных участков) в полости клатратной решетки воды, но также встраиванием групп NН непосредственно в структуру самой решетки (1, 2, 6). По-видимому, в условиях нашего эксперимента имеет место взаимный стабилизирующий эффект влияния азотистых оснований ДНК и молекул гидрофобного газа в постройке клатратной решетки воды. Количество клатратных структур увеличивается, пока основания ДНК оказывают влияние на имеющуюся в системе воду. Это подтверждается экспериментом, поскольку эффект стабилизации снижается (количество клатратов уменьшается) при больших влажностях ДНК (∼30 молекул Н2О на нуклеотид) так как молекулы внешних монослоев воды испытывают слабое влияние азотистых основании ДНК.
 |
 |
 |
Рис. 3. | ||
Таким образом, результаты работы свидетельствуют, что под давлением ксенона 1 МПа при температурах более 273° К° в препаратах ДНК с относительной влажностью ≥ 86% происходит образование клатратных структур из молекул этого газа и воды, количество и стабильность которых возрастает при понижении температуры. Повидимому, полинуклеотидная матрица ДНК участвует в стабилизации клатратов ксенона. В присутствии ксенона в препаратах ДНК с относительной влажностью ≥ 98% устраняется структурный конформационный переход в области температур 258—268° К°, связанный с резким изменением подвижности молекул и наблюдаемый в образцах в отсутствие газа.
Список литературы
1.Бык С. Ш., Макогон Ю. Ф., Фомина В. И. Газовые гидраты, — М.: Химия, 1980. — 296 с.
2.Дядин Ю. А., Кузнецов П. П., Яковлев И. И. Диаграмма состояния системы вода-диэтиламин в области кристаллизации при давлениях до 3000 бар // Докл. АН СССР. — Сер. Химия. — 1972.— 203, .№ 4. — с. 825 — 828.
3.Новиков И. А., Рыжов В. Г., Волков В. Я. - Исследование системы ДНК-связанная вода в области отрицательных температур методом ЯМР-релаксации // Материалы V совещ. по «информационным изменениям биополимеров в растворах, — Тбилиси; Телави. 1980. — с. 47.
4.Родин В. Я Образование клатратов ксенона я состояние воды в бактериальных суспензиях но данным метода ЯМР: Автореф. дисс. канд. физ-мат. наук. — Пущино: Ин-т биол. физики АН СССР. 1985. — 17 с.
5. Сухоруков Б. И., Новиков И. А. Исследование температурных структуоных переходов в системе ДНК «связанная вода методом спинового зонда // Пущнно. — 1981. — 37 с — Рук. депон. в ВИНИТИ.— № 3361—81.
|
Волков В.Я., Новиков И.А., Родин В.В. |

|
|
Внимание! Вы находитесь в библиотеке «Ordo Deus». Все книги в электронном варианте, содержащиеся в библиотеке «Ordo Deus», принадлежат их законным владельцам (авторам, переводчикам, издательствам). Все книги и статьи взяты из открытых источников и размещаются здесь только для чтения. |
|
Библиотека «Ordo Deus» не преследует никакой коммерческой выгоды. |
|
Все авторские права сохраняются за правообладателями. Если Вы являетесь автором данного документа и хотите дополнить его или изменить, уточнить реквизиты автора, опубликовать другие документы или возможно вы не желаете, чтобы какой-то из ваших материалов находился в библиотеке, пожалуйста, свяжитесь с нами по e-mail: |
Вас категорически не устраивает перспектива безвозвратно исчезнуть из этого мира? Вы желаете прожить ещё одну жизнь? Начать всё заново? Исправить ошибки этой жизни? Осуществить несбывшиеся мечты? Перейдите по ссылке: «главная страница».
|
© Ordo Deus, 2010. При копировании ссылка на сайт http://www.ordodeus.ru обязательна. |