Пороки сердца приобретённые |
||
 |
 |
Оглавление
|
Пороки сердца приобретённыеПороки сердца приобретённые — пороки, возникшие в результате заболеваний или травматических повреждений сердца. Оглавление Основные клинические формы приобретённых пороков сердца Недостаточность митрального клапана (митральная недостаточность) Стеноз левого атриовентрикулярного отверстия (митральный стеноз) Сочетанный митральный порок сердца (митральная болезнь) Недостаточность аортального клапана (аортальная недостаточность) Стеноз устья аорты (аортальный стеноз) Сочетанный аортальный порок сердца Недостаточность трикуспидального клапана (трикуспидальная недостаточность) Стеноз правого атриовентрикулярного отверстия (трикуспидальный стеноз) Сочетанный трикуспидальный порок сердца Недостаточность клапана лёгочного ствола Консервативное лечение больных с приобретёнными пороками сердца Особенности приобретённых пороков сердца у детей Хирургическое лечение больных с приобретёнными пороками сердца Таблица. Основные диагностические признаки наиболее распространённых приобретённых пороков сердца Общие сведенияКак и врождённые пороки сердца (смотри полный свод знаний: Пороки сердца врождённые), Пороки сердца приобретённые формируют патологический состояния с нарушением насосной функции сердца, корригируемым компенсаторными процессами, при недостаточности которых развивается острая или хронический недостаточность кровообращения, угрожающая жизни или инвалидизирующая больного. Первые описания анатомических изменений клапанного аппарата сердца (смотри полный свод знаний) относятся к 17 век, а прижизненная диагностика Пороки сердца приобретённые стала осуществляться лишь в 19 век после внедрения в клинические, практику методов аускультации и перкуссии. Важное значение для понимания природы Пороки сердца приобретённые и их диагностики имели в этот период работы Ж. Буйо, особенно его «Клинический трактат о заболеваниях сердца» (1835). В дальнейшем совершенствованию диагностики Пороки сердца приобретённые способствовало появление и разработка рентгенологическое методов исследования, электрокардиографии (смотри полный свод знаний), сфигмографии (смотри полный свод знаний) и особенно фонокардиографии (смотри полный свод знаний)» С середины 20 век учение о Пороки сердца приобретённые существенно обогатилось, благодаря широкому применению новых методов диагностики, в частности ангиокардиографии (смотри полный свод знаний), зондирования сердечных камер (смотри полный свод знаний: Катетеризация сердца) и эхокардиографии (смотри полный свод знаний), но наиболее важным достижением этого времени явилось создание методов хирургического лечения неблагоприятных по прогнозу клинические, форм Пороки сердца приобретённые, в том числе протезирования клапанов сердца (смотри полный свод знаний). В СССР основополагающими в этом направлении были труды А. Н. Бакулева и Б. В. Петровского, создавших первые отечественные школы кардиохирургии. |
Статистика Пороки сердца приобретённые показывает, что среди населения они выявляются достаточно часто и составляют, по обобщённым данным Йонаша (У. Jonas, 1958), от 20 до 25% всех органических заболеваний сердца. Из изолированных клапанных пороков наиболее часто обнаруживается поражение клапанов левых отделов сердца: митральные пороки составляют, по разным данным, от 50 до 70%, а аортальные — от 8 до 27%, в то время как изолированные трикуспидальные пороки и пороки клапана лёгочного ствола — не более 1 %. Однако при комбинированных клапанных пороках, общая частота которых достигает не менее 1/3 всех случаев Пороки сердца приобретённые, поражение трикуспидального клапана отмечается примерно у половины больных.
В этиологии Пороки сердца приобретённые ведущее место занимает ревматизм (смотри полный свод знаний), с ним связано формирование не менее 90% всех Пороки сердца приобретённые К другим заболеваниям, при которых возможно формирование Пороки сердца приобретённые, относятся атеросклероз (у пожилых лиц), сифилис, бактериальный эндокардит, ишемическая болезнь сердца и травмы сердца, которые могут осложняться формированием как клапанных, так и внеклапанных пороков (разрывы сердечных перегородок, папиллярных мышц и другие). Казуистической является связь происхождения Пороки сердца приобретённые с опухолями и паразитарными поражениями сердца.
Классификация Пороки сердца приобретённые составляет часть общей классификации пороков сердца (смотри полный свод знаний). Основная группа Пороки сердца приобретённые представлена пороками клапанного аппарата; внеклапанные Пороки сердца приобретённые, например, приобретённые дефекты межжелудочковой или межпредсердной перегородок, наблюдаются весьма редко. Поэтому в общеклиническом аспекте и для унификации терминологии важно традиционное разделение Пороки сердца приобретённые по локализации клапанного поражения (митральный, аортальный, трикуспидальный клапаны) и по виду этого поражения — в форме недостаточности клапана (insufficientia valvulae) и в форме сужения отверстия в зоне клапана (stenosis ostii).
Для обозначения сочетанного поражения одного клапана (в виде его недостаточности и в виде стеноза отверстия в зоне того же клапана) рекомендуют термин «сочетанный порок» (например, сочетанный аортальный порок, то есть сочетание недостаточности клапана и стеноза устья аорты). При поражении двух и более клапанов порок обозначают как комбинированный (например, комбинированный митрально-аортальный порок). По состоянию общей гемодинамики Пороки сердца приобретённые подразделяют на компенсированные, то есть не проявляющиеся недостаточностью кровообращения, и декомпенсированные, то есть приведшие к недостаточности кровообращения (смотри полный свод знаний). Для случаев, когда признаки декомпенсации порока сердца появляются лишь при необычных для больного физических или других (например, лихорадка, беременность) нагрузках на систему кровообращения, иногда употребляют термин «субкомпенсированный порок». По степени выраженности или стадиям течения порока отдельных клапанов его нередко классифицируют более подробно с позиций кардиохирургии; например, выделяют 5 стадий течения митрального стеноза, по А. Н. Бакулеву и Е. А. Дамир (смотри полный свод знаний: раздел «Хирургическое лечение»).
От Пороки сердца приобретённые как самостоятельной формы патологии, обусловленной анатомическими изменениями клапанного аппарата, необходимо отличать нарушения клапанной функции в виде относительной недостаточности клапана или относительного стеноза отверстия в зоне клапана без изменения структуры последнего. Относительная недостаточность клапана может быть обусловлена снижением тонуса папиллярных мышц с неполным смыканием створок клапана (мышечная недостаточность) или нарушением сокращения циркулярных мышц, которые в нормальных условиях в период систолы уменьшают просвет отверстия, а при патологии допускают расширение последнего настолько, что даже неизменённый клапан не полностью его закрывает. Об относительном стенозе говорят в случаях, когда кровоток через нормальное отверстие возрастает столь резко, что появляются гемодинамические признаки протекания через суженное отверстие. Относительные недостаточность и стеноз часто развиваются при декомпенсации кровообращения, обусловленной органическим клапанным пороком, обогащая и искажая физикальную картину и усугубляя гемодинамические нарушения. Например, в результате декомпенсации аортального порока из-за дилатации левого желудочка может возникать относительная недостаточность митрального клапана (митрализация аортального порока), течение митрального порока при дилатации правого желудочка иногда осложняется относительной недостаточностью трёхстворчатого клапана. Присоединение относительной недостаточности (или относительного стеноза) не даёт права обозначать порок как комбинированный, хотя гемодинамические и клинические признаки в этих случаях трудно различимы с возникающими при сложных органических пороках.
Анатомические нарушения клапанного аппарата сердца при Пороки сердца приобретённые ведут к изменениям условий внутрисердечной гемодинамики, специфичным при отдельных видах Пороки сердца приобретённые и формирующим в связи с этим особенности клинические, проявлений каждого порока. Последнее обстоятельство делает целесообразным изложение патогенеза конкретных гемодинамических нарушений при описании отдельных основных клинические, форм Пороки сердца приобретённые (смотри полный свод знаний: ниже).
Снижение эффективности насосной функции сердца, неизбежное при клапанном пороке и пропорциональное степени нарушения клапанной функции, во многих случаях и часто многие годы не проявляется расстройствами общей гемодинамики благодаря раннему развитию процессов компенсации при возникновении порока. Эти компенсаторные процессы, контролируемые нейрогуморальными механизмами регуляции, осуществляются на разных системных уровнях, причём наибольшее значение имеют компенсаторные изменения функции и морфологии самого сердца и компенсаторные реакции сосудов.
Компенсаторные процессы на уровне сердца начинаются с его гиперфункции, имеющей рефлекторную природу. При пороках, ведущих к снижению объёма крови, нагнетаемого в аорту за время систолы, рефлекс осуществляется с интерорецепторов каротидного синуса, что ведёт к уменьшению тормозящего влияния на сердце нерва Геринга, а при значительном снижении систолического внутрикаротидного объёма — к общей активации симпатических нервов и увеличению секреции катехоламинов надпочечниками. При пороках, ведущих к повышению давления в правом предсердии, основное значение имеет рефлекс Бейнбриджа (смотри полный свод знаний: Рефлексогенные зоны), начинающийся с барорецепторов в стенках правого предсердия и устий полых вен и выражающийся в активации ускоряющего нерва сердца. В результате этих и других рефлексов увеличивается частота и мощность сердечных сокращений, то есть достигается повышение работы миокарда, необходимое для преодоления дополнительной гемодинамической нагрузки, обусловленной клапанным пороком. Характер и степень этой нагрузки неодинаковы при недостаточности клапанов и при стенозе отверстий. В первом случае возникает так называемый нагрузка объёмом: общий объем крови, выбрасываемый при систоле из желудочка, включает, кроме эффективного ударного объёма, ещё и объем крови, регургитирующей через отверстие в зоне повреждённого клапана (смотри полный свод знаний: Регургитация). Вследствие этого возрастают диастолический объем соответствующего желудочка сердца и амплитуды его сокращений. Из-за неполного смыкания повреждённых клапанов герметизация камеры желудочка в начале его систолы не достигается; поэтому фазовая структура систолы характеризуется укорочением или даже отсутствием периода изоволюмического напряжения (смотри полный свод знаний: Поликардиография), что препятствует существенному повышению внутри-желудочкового давления (смотри полный свод знаний: Внутрисердечное давление). В результате требуемое компенсаторное повышение работы сердца при этого вида пороках в основном пропорционально массе регургитационного объёма крови и расстоянию его перемещения. При стенозах отверстий миокард соответствующей камеры сердца испытывает иной вид нагрузки — так называемый нагрузку сопротивлением, которая требует большей гиперфункции миокарда, чем при недостаточности клапанов, ибо гидравлическое сопротивление пропорционально четвертой степени уменьшения радиуса отверстия. Преодоление дополнительного сопротивления возможно лишь путём соответствующего повышения давления внутри сердечной камеры, из которой отток крови ограничен стенозом, что требует значительного повышения энергозатрат на изгнание неизменённого объёма крови через суженное отверстие за единицу времени. При недостаточном повышении энергии сокращения стенок сердечной камеры период изгнания крови из неё удлиняется.
Так как гиперфункция миокарда при Пороки сердца приобретённые имеет долговременный характер, она завершается формированием устойчивых условий для её обеспечения — компенсаторной гипертрофии миокарда. Многосторонние исследования Ф. 3. Меерсона показали, что в основе компенсаторной гипертрофии миокарда лежит механизм активации генетического аппарата его клеток дефицитом высокоэргических соединений (смотри полный свод знаний), возникающим в процессе устойчивой гиперфункции. Гипертрофия не только уменьшает степень дополнительной нагрузки на единицу массы миокарда (за счёт роста массы при неизменённой нагрузке), но и увеличивает энергетические резервы сердца вследствие гипертрофии и гиперплазии митохондрий, осуществляющих ресинтез АТФ (смотри полный свод знаний: Компенсаторные процессы). При малых степенях недостаточности клапанной функции процесс гипертрофии прекращается по достижении компенсации порока вследствие обеспечения энергетического баланса на новом уровне функционирования миокарда. Если порок ведёт к значительной гиперфункции, то процесс усиленной гипертрофии не сопровождается адекватным обеспечением образования и эффективного использования дополнительной энергии, и полная компенсация в этих случаях не достигается.
Недостаточная компенсация порока гиперфункцией миокарда сопровождается дополнительными компенсаторными процессами в сосудистой системе, среди которых особое место занимают рефлекс Парина, рефлекс Китаева и феномен так называемый централизации кровообращения. Рефлекс Парина (смотри полный свод знаний: Кровяное депо) имеет место при Пороки сердца приобретённые, ведущих к повышению давления в правых камерах сердца, где раздражение барорецепторов приводит к снижению притока крови по полым венам (уменьшение нагрузки сердца объёмом за счёт рефлекторной секвестрации части крови в физиологический депо большого круга кровообращения, в частности в печени и селезёнке. Рефлекс Китаева (смотри полный свод знаний: Китаева рефлекс) — гипертония лёгочных артериол в ответ на повышение давления в лёгочных венах — имеет место при пороках, сопровождающихся повышением давления в левом предсердии, особенно при митральном стенозе. Этот рефлекс в существенной мере предохраняет от гипертензии лёгочные капилляры, препятствуя развитию отёка лёгких. Феномен централизации кровообращения наблюдается при значительном снижении эффективного ударного объёма сердца и обусловлен рефлекторной (с интерорецепторов каротидного синуса) активацией симпатоадреналовой системы с генерализованной тонической реакцией периферических резистивных сосудов, что ведёт к перераспределению крови преимущественно к мозгу и сердцу при снижении кровотока в других органах, скелетных мышцах и коже.
Декомпенсация порока ведёт к сердечной недостаточности (смотри полный свод знаний) и различной степени недостаточности кровообращения (смотри полный свод знаний), имеющих свои особенности при отдельных клинические, формах Пороки сердца приобретённые
Патологическая анатомия
Патологоанатомическая картина Пороки сердца приобретённые зависит от этиологии порока и в подавляющем большинстве случаев представлена разнообразными изменениями клапанного аппарата сердца и подклапанных структур, формирующими стеноз клапанных отверстий или недостаточность клапана вследствие деструкции и деформации его створок.
Ревматические пороки сердца обнаруживаются как в форме изолированного поражения клапанов (митрального или аортального), так и в почти патогномоничной для этой этиологии Пороки сердца приобретённые форме комбинированных и одновременно сочетанных пороков. Наиболее часто при ревматизме (смотри полный свод знаний) обнаруживают митральный стеноз и сочетанный митральный порок сердца, в том числе и с преобладанием недостаточности митрального клапана.
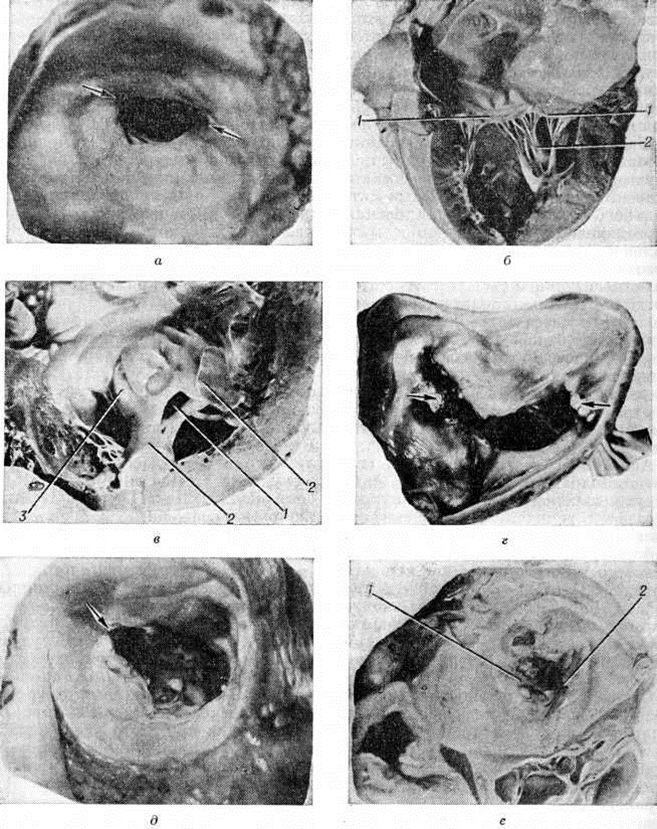
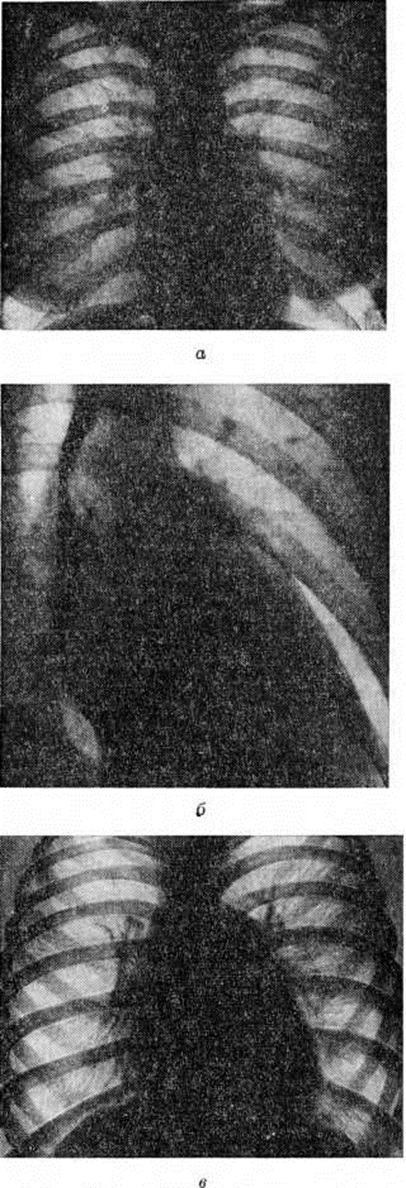
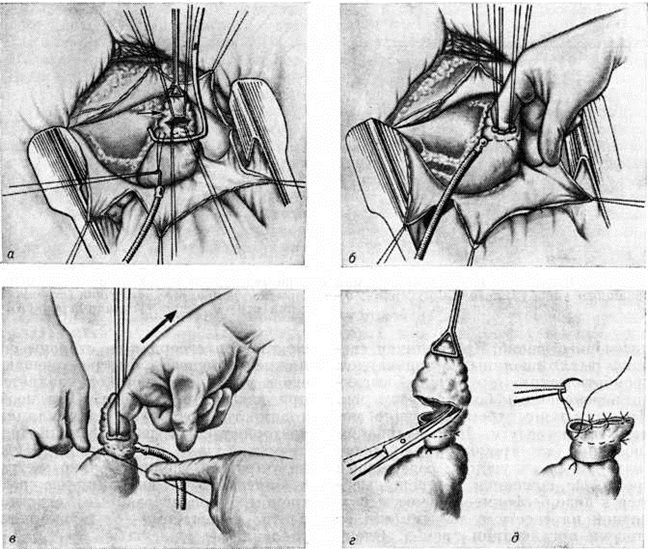
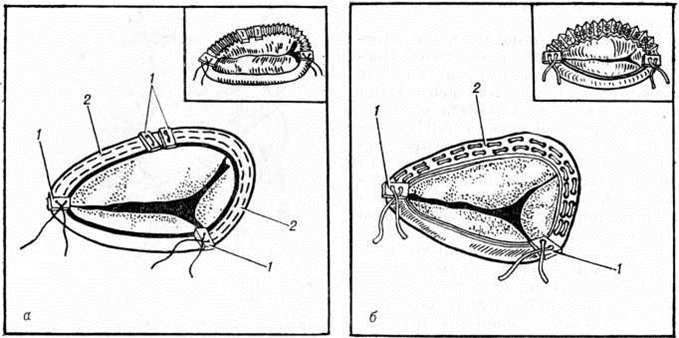
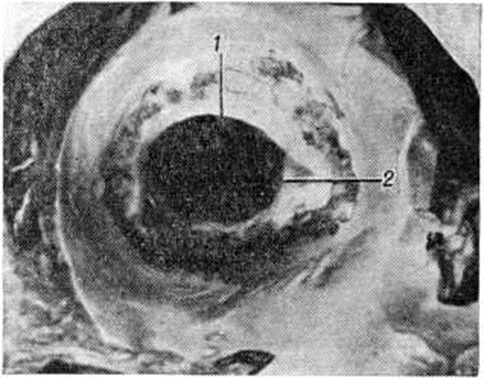
Митральный стеноз характеризуется уменьшением площади клапанного отверстия (в норме около 6 см²) в 2—14 раз. В исходе рецидивирующего эндокардита (смотри полный свод знаний) створки становятся утолщёнными, склерозированными, белесоватого цвета, сращёнными между собой и с хордами в области комиссуральных вырезок (рисунок 1, а). В зависимости от локализации и течения эндокардита формируются три анатомических варианта митрального стеноза: типа диафрагмы, воронки и среднего типа.
При стенозе типа диафрагмы, который является самым частым вариантом (57,8—85%), сращённые створки располагаются на уровне фиброзного кольца (рисунок 1, б), хорды остаются интактными, что облегчает хирургическое лечение порока.
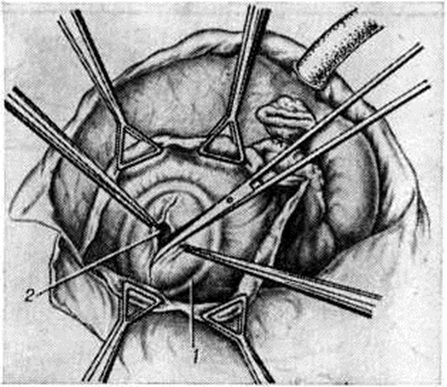
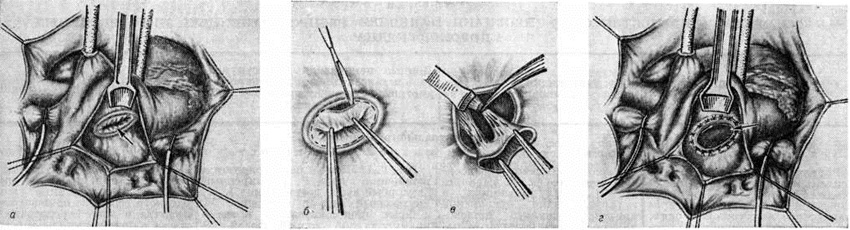
Стеноз типа воронки (рисунок 1, в) возникает в результате вальвулита и хордального эндокардита (смотри полный свод знаний), что приводит к массивным сращениям створок клапана с хордами и заращению межхордальных пространств (рисунок 2, а, г, д). Комиссуротомия при таком варианте порока неэффективна. Средний тип митрального стеноза характеризуется ограниченными сращениями створок и хорд в области одной из комиссур.
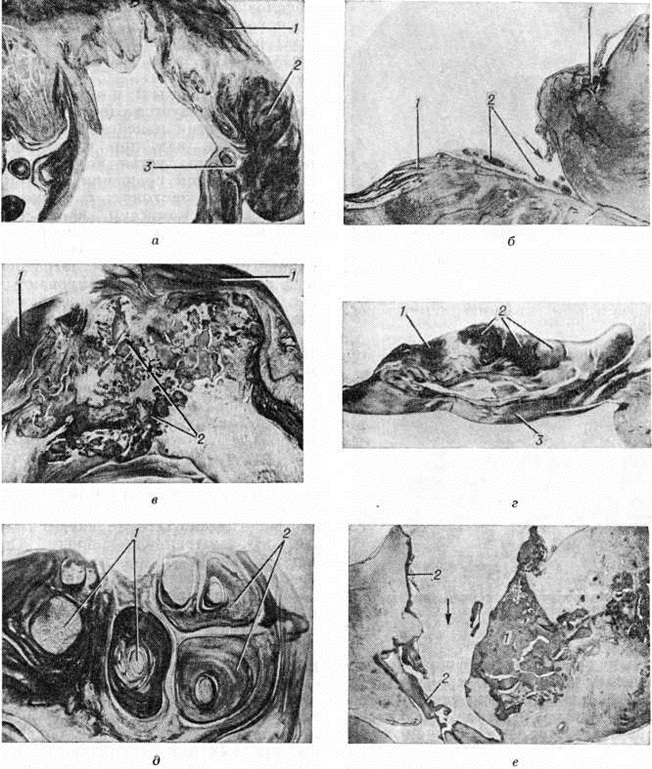
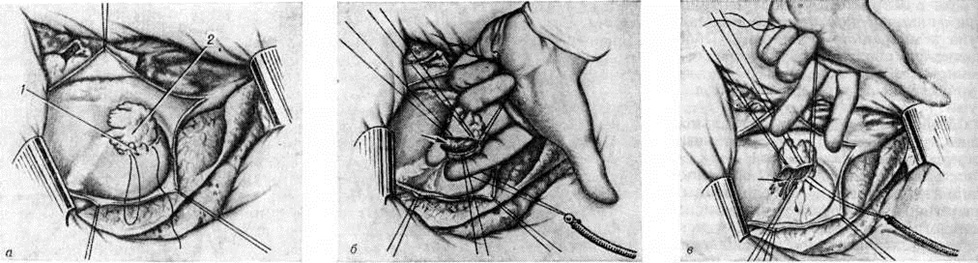
Гистологический исследование показывает, что утолщение створок происходит за счёт склероза слоёв, обращённых к току крови и состоящих из фиброзно-эластической ткани с обилием вновь образованных сосудов различного калибра. Эластические мембраны у основания створок гипертрофируются и, проникая в створки, разделяются на несколько слоёв, которые вплетаются в новообразованную слоистую фиброзно-эластическую ткань, составляющую утолщённый край клапана (рисунок 2, а). Окраска на эластин открывает в глубине слоистой ткани перегибы первичного края створок, происхождение которых объясняют или как результат ретракции ткани при организации тромбов, или механическим натяжением створок при дилатации фиброзного кольца в условиях миокардита и ударным действием обратного кровотока. Обнаруживаются скудно выраженные признаки активности ревматического процесса в виде очагов метахромазии с оживлением гистиоцитов, набухания фиброзных волокон, периваскулярных скоплений лимфоцитов, плёнчатых наложений фибрина с палисадообразной реакцией гистиоцитов под ними. Гранулемоподобные узелки являются большой редкостью.
 |
|  |
Рис. 3. | ||
 |
|  |
Рис. 4. | ||
Ригидность клапана обусловлена гиалинозом ткани по линии замыкания створок и в комиссурах. Здесь видны большие поля гиалинизированной суданофильной ткани, лишённой эластических волокон, подвергающейся растрескиванию, пропитыванию фибрином. Эти участки имеют вид спонтанных надрывов (рисунок 2, б), содержащих фибринозные массы, без признаков организации последних. В их краях располагаются лямблевские ворсинки, содержащие зернисто-перерождённые эластические волокна и уходящие своими корнями в поверхностные слои клапана, где они соединяются с разорванными эластическими мембранами. Эти изменения брадитрофной склерозированной ткани создают местные предпосылки для развития обызвествления (смотри полный свод знаний: Кальциноз). Оно выражается в трёх морфологический вариантах: диффузное пылевидное обызвествление фиброзной ткани; интенсивные участки петрификации с ландкартообразными контурами, имеющие макроскопически вид тонких пластинок жёлтого цвета; очаговые кальцинаты. Последние развиваются из пластинчатых петрификатов (смотри полный свод знаний), в центре которых возникают фрагментация, деструкция коллагеновых волокон, плазморрагия. Такие очаги белковой апоплексии петрифицируются по периферии. Процесс количественно нарастает с образованием крупнобугристых кальцинатов (рисунок 2, в). Коллагеновые и эластические структуры вокруг них разрываются, и кальцинаты выходят на поверхность створок, чаще предсердную, покрываются фибрином и макроскопически могут напоминать полипозно-язвенный эндокардит (рисунок 1, г). Вокруг развивается интенсивная васкуляризация, полиморфно-клеточная инфильтрация, что создаёт картину грануляционной ткани. Её клеточные элементы врастают в белковые массы, лизируют их, формируют фиброзные пучки. Развивающиеся на этом фоне процессы оссификации придают гистологический картине исключительную пестроту. Кальцинаты локализуются чаще в дистальных отделах створок, комиссурах и, по данным Б. В. Шехонина с соавторами (1972), могут охватывать до 56% площади клапана, отражаясь на степени подвижности створок, проходимости и смыкаемости клапана.
Для воронкообразного митрального стеноза характерны гиперпластические разрастания слоистой фиброзно-эластической ткани в дистальных отделах створок, в бывших межхордальных пространствах, что приводит к прочному сращению створок с хордами на всем их протяжении (рисунок 2, г). Это способствует иммобилизации клапана, ригидности его выходного отверстия. Гиперэластоз клапана, разрастание слоистой фиброзно-эластической ткани в нем (рисунок 2, д) расцениваются как компенсаторно-приспособительные, функционально обусловленные структуры.
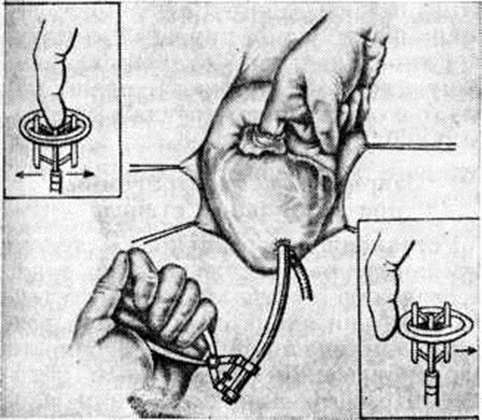
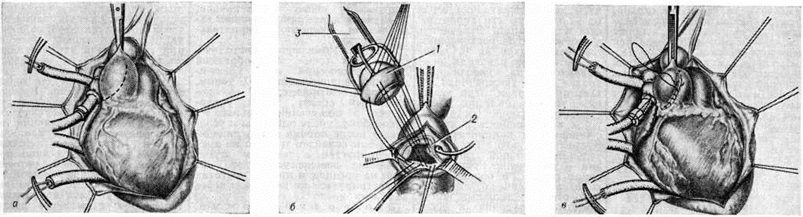
Хирургические разрывы митральных комиссур хорошо различимы, особенно при стенозе типа диафрагмы (рисунок 1, д), а при воронкообразном стенозе имеют вид надрывов. Края разделённых комиссур микроскопически выглядят рваными, они покрыты фибринозными массами, имеют дополнительные трещины, пропитаны кровью и фибрином (рисунок 2, е). К 8-му дню после операции заметен некроз ткани в краях комиссуры, организация фибрина; к 20-му дню формируются тонкие слои соединительной ткани; к 27-му дню отмечается очаговая эндотелизация поверхности. Однако некроз гиалинизированных краёв комиссур и тромботические наложения могут длительное время не подвергаться каким-либо изменениям. Через несколько лет клапан выглядит ригидным, гиалинизированным с выраженным кальцинозом (рисунок 1, е), в краях разрыва определяются белесоватые рубцы с гладкой поверхностью. Истинный рестеноз наблюдается редко (у 2—12% оперированных больных) за счёт организации тромбов, заполняющих щель разрыва комиссуры. Сужение щели разрыва может быть обусловлено избыточным разрастанием фиброзно-эластической ткани в его краях за счёт организации рецидивирующих тромбов. Ложный рестеноз, развивающийся в клинике в среднем через 3 года, объясняется неадекватной комиссуротомией, прогрессированием фиброза, гиалиноза ткани в области операции. Крупнобугристые кальцинаты комиссур затрудняют, но не препятствуют разделению комиссур и грозят эмболией известковыми частицами в сосуды мозга. В качестве осложнения на краях разделённых комиссур может развиваться септический эндокардит чаще стафилококковой природы.
Митральная недостаточность имеет несколько морфологический критериев, основным из которых является неполное смыкание створок митрального клапана. Она может быть результатом выраженного склероза (смотри полный свод знаний), гиалиноза створок при малой степени их сращения (рисунок 3). Неплотное смыкание створок отмечается при выраженном валикообразном краевом склерозе клапана, а также при воронкообразном митральном стенозе (за счёт иммобилизации створок, хорд и ригидности краёв отверстия) и при кальцинозе клапана, который делает края отверстия каменистыми, несмыкаемыми. Реже митральная недостаточность обусловлена деформацией створок в исходе язвенного эндокардита (смотри полный свод знаний) или их сращением со стенкой желудочка в исходе подклапанного тромбоэндокардита.
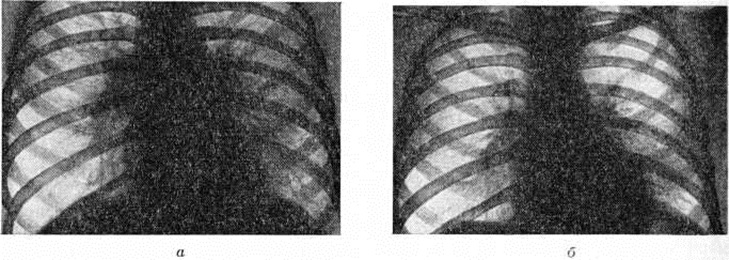
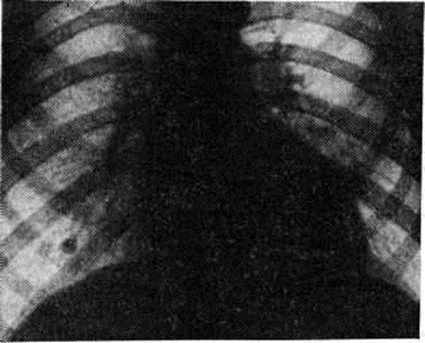
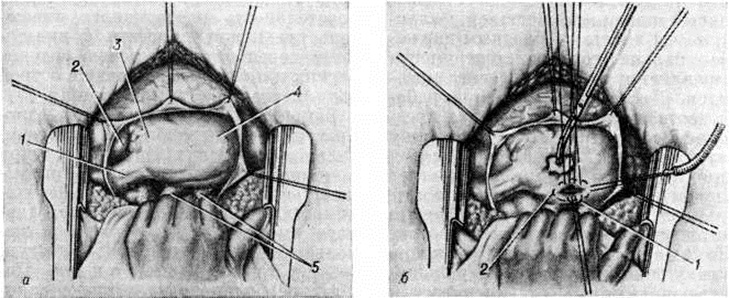
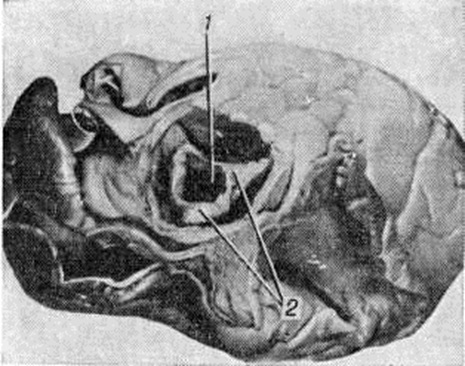
Аортальный порок сердца характеризуется теми же закономерностями изменения структуры клапана, как при митральном пороке. Стеноз устья аорты является следствием сращения соседних створок, или заслонок, с формированием трёх комиссур, из-за чего клапанное отверстие приобретает треугольную форму (рисунок 4). Микроскопически определяется выраженный гиперэластоз склерозированных заслонок, гиперпластическое разрастание слоистой фиброзно-эластической ткани в их краях (рисунок 5). В глубине этой ткани в ряде случаев можно выявить перегиб первичного края заслонок. Характерным является развитие, крупнобугристого кальциноза, резко деформирующего клапан и усугубляющего как стеноз устья, так и недостаточность клапана.
Трикуспидальные стеноз и недостаточность морфологически характеризуются так же, как митральные пороки. Однако обычно обнаруживаются менее выраженные изменения благодаря меньшей интенсивности в правой половине сердца предшествующего эндокардита.
Пороки сердца в исходе бактериального эндокардита чаще всего связаны с поражением аортального или митрального клапанов. Следствием септического полипозно-язвенного эндокардита является обнажение краевых или центральных узур заслонок, развитие крупнобугристых кальцинатов, гиалиноз и гиперпластическое разрастание ткани в дистальных отделах клапанов. Чаще порок формируется в виде недостаточности клапана.
Порок сердца сифилитической этиологии обычно бывает изолированно аортальным, преимущественно в виде недостаточности клапана. Предполагается два механизма формирования порока. Чаще клапан вовлекается в патологический процесс последовательно при наличии мезаортита с аневризмой восходящей аорты, что само по себе вызывает растяжение и недостаточность заслонок. Последняя усугубляется распространением гиперпластического склероза интимы аорты нисходящим путём в пазухи и на зоны прикрепления заслонок к аорте. Их боковые отделы оказываются замурованными в фиброзно-эластическую ткань. Формируется валикообразное утолщение края заслонок, представленное разрастанием слоистой фиброзно-эластической ткани. Другой предполагаемый механизм склероза заслонок — развитие его вследствие специфического эндокардита, характеризующегося лимфоплазмоцитарными инфильтратами и организацией тромботических наложений.
Порок сердца атеросклеротической природы наблюдается обычно в клапане аорты, в котором первоначально развивается возрастной гиалиноз (смотри полный свод знаний) и очаговый липоидоз фиброзного пласта заслонок с последующим пылевидным и более интенсивным обызвествлением и формированием в дальнейшем пластинчатого петрификата. В связи с движением заслонок петрификат подвергается разлому с излиянием белков плазмы в очаги деструкции, их последующим обызвествлением. Процесс может прогрессировать в результате повторных растрескиваний петрификатов, вокруг которых со временем появляются полиморфно-клеточные инфильтраты с обилием сосудов и явлениями резорбции и организации белковых масс. В краях заслонок формируются реактивные напластования слоистой фиброзно-эластической ткани. В результате развивается крупнобугристый кальциноз клапана, создающий как сужение устья аорты, так и недостаточность клапана. Сходство морфологический картины кальцинатов с изменениями аорты при атеросклерозе (смотри полный свод знаний) и развитие их на почве возрастных изменений заслонок послужили формальным основанием для трактовки его атеросклеротической сущности. Однако при резко выраженном процессе болезнь определяют как изолированный кальциноз аортального клапана. Существует мнение, что он является результатом спонтанно зажившего септического эндокардита или исходом изолированного ревматического эндокардита клапана аорты, поскольку, по некоторым данным, в большинстве таких наблюдений имеются признаки перенесённого ревматизма. При локализации аналогичного процесса в митральном фиброзном кольце формируются крупнобугристые кальцинаты, проникающие в основание створок, миокард желудочка.
Основные клинические формы приобретённых пороков сердца
Недостаточность митрального клапана (митральная недостаточность)
Митральная недостаточность — наиболее часто диагностируемый порок сердца, который чаще, чем другие Пороки сердца приобретённые, бывает не связан с ревматизмом. При ревматизме возникновение митральной недостаточности обусловлено ревматическим эндокардитом, ведущим к развитию рубцовых контрактур, скручивания и других видов деформации створок митрального клапана. В этих случаях митральная недостаточность обычно сочетается с сужением левого атриовентрикулярного отверстия. Другой возможной причиной митральной недостаточности является атеросклероз, вызывающий краевую ретракцию створок митрального клапана; при этом в развитии порока определённую роль играет укорочение хорд или гипотония папиллярных мышц, вызванная нарушением их кровоснабжения или развитием атеросклеротического кардиосклероза. Митральная недостаточность может быть также результатом травмы или бактериального эндокардита. Наконец, в ряде случаев створки митрального клапана остаются интактными, и недостаточность клапана обусловливается поражением других структур сердца, в частности пролабированием одной из створок митрального клапана в полость левого предсердия во время систолы левого желудочка. Оно может быть следствием врождённой слабости соединительной ткани с повышенной растяжимостью хорд — при синдроме Марфана (смотри полный свод знаний: Марфана синдром), гаргоилизме (смотри полный свод знаний), синдроме Элерса — Данлоса (смотри полный свод знаний: Десмогенез несовершенный), следствием нарушения сократимости папиллярных мышц (при воспалительных процессах, ишемии или инфаркте миокарда), а иногда возникает по не вполне ясной причине.
Патогенез гемодинамических нарушений. Основным следствием митральной недостаточности является систолическая регургитация крови из левого желудочка в левое предсердие. Из-за анатомически обусловленного высокого сопротивления потоку в зоне дефекта клапана (даже при значительном несмыкании створок) регургитация в начале систолы практически отсутствует, что способствует развитию изоволемического напряжения левого желудочка, хотя и укороченного по времени, но достаточного для создания в желудочке давления, открывающего аортальный клапан. В результате максимум регургитации крови в предсердие совпадает с началом её изгнания в аорту. Турбулентный поток регургитируемой крови через клапанный дефект обусловливает один из характерных симптомов порока — систолический шум в проекции митрального клапана.
Регургитация до 5 миллилитров крови за систолу не отражается на общей гемодинамике. Снижения выброса крови в аорту в большинстве случаев не наблюдается (по экспериментальным данным, он восстанавливается уже через несколько сердечных циклов после создания порока). Поэтому масса регургитируемой крови создаёт дополнительную нагрузку объёмом на левый желудочек и левое предсердие, обусловливая их гиперфункцию, а в последующем — гипертрофию. Дополнительное растяжение предсердия повышает давление в нем и при значительной митральной недостаточности ведёт к его дилатации, повышению давления в лёгочных венах и вторичной артериальной гипертензии малого круга кровообращения (смотри полный свод знаний), создающей нагрузку сопротивлением на правый желудочек. Этим объясняются признаки правожелудочковой сердечной недостаточности (смотри полный свод знаний), которыми нередко проявляется декомпенсация порока.
Клинические проявления и течение различаются при медленном развитии митральной недостаточности в результате вальвулита или атеросклероза (так называемый хронический недостаточность митрального клапана) и при внезапном её возникновении вследствие разрыва сухожильных хорд (спонтанном, при травме сердца, при бактериальном эндокардите) или папиллярной мышцы (при инфаркте миокарда), то есть при так называемый острой недостаточности митрального клапана. Имеются особенности и в проявлениях пролапса створок клапана.
Хроническая митральная недостаточность, если она протекает без осложнений, не сочетается с другими Пороки сердца приобретённые и активным кардитом, в большинстве случаев не приводит к заметным изменениям кровообращения. Обычно больные не предъявляют жалоб в течение нескольких десятков лет после возникновения порока, выполняя привычные нагрузки. Лишь при значительной митральной недостаточности, обычно формирующейся после повторных атак ревматизма, симптомы декомпенсации порока могут появиться в ближайшие годы или месяцы. В таких случаях больные жалуются на ощущение сердцебиения и одышку при физическом напряжении, утомляемость; в последующем появляются отеки нижних конечностей. Объективные симптомы порока — см. таблицу.
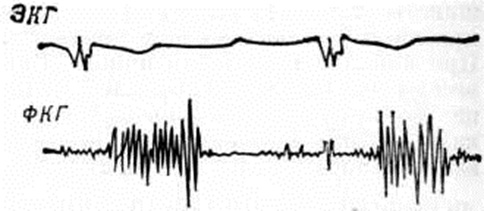
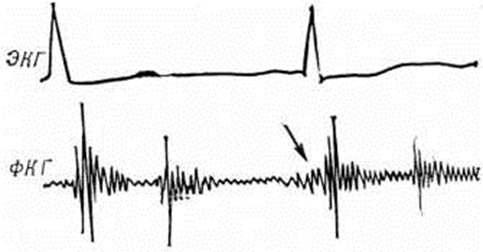
Аускультативные признаки порока и соответствующие изменения ФКГ обычно выявляются сразу после его возникновения, но не всегда правильно оцениваются. При выраженной митральной недостаточности нередко удаётся обнаружить усиление физиологический III тона сердца, иногда короткий диастолический «шум заполнения» левого желудочка (смотри полный свод знаний: Сердечные шумы), служащий проявлением относительного митрального стеноза.
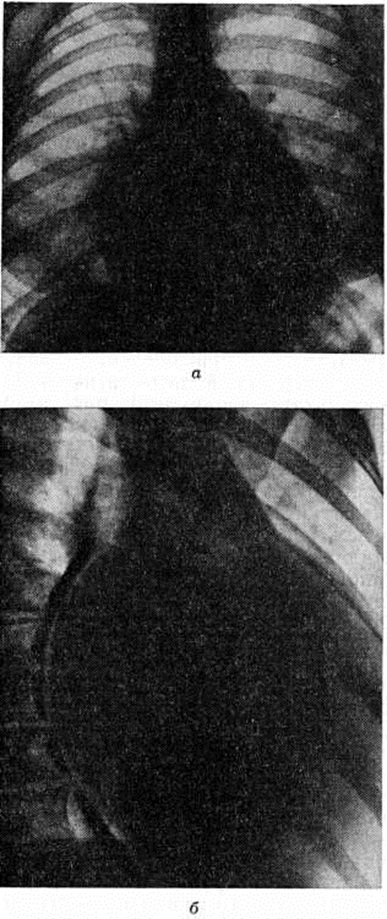
Гипертрофия и дилатация левых отделов сердца отчётливо выявляются перкуссией и пальпацией лишь через несколько лет после формирования порока, но в более ранние сроки могут быть обнаружены при рентгенологическое исследовании.
В случае декомпенсации порока, которая отмечается нередко на фоне его осложнения постоянной мерцательной аритмией (смотри полный свод знаний), развивается, как правило, прогрессирующая правожелудочковая сердечная недостаточность, рефрактерная к терапии.
Течение митральной недостаточности атеросклеротической этиологии обычно благоприятное, медленное. У некоторых больных может возникать столь же медленно прогрессирующая аортальная недостаточность, что было отмечено ещё А. Юшаром.
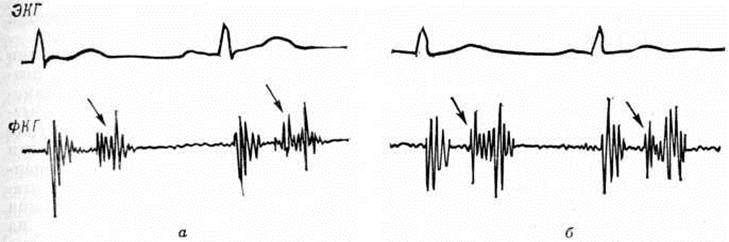
Острая митральная недостаточность (смотри полный свод знаний: таблицу) часто проявляется внезапным развитием нарастающей недостаточности левого желудочка (сердечная астма, отёк лёгких), как правило, рефрактерной к лечению, и столь же внезапным появлением грубого систолического шума на верхушке сердца при исчезновении I тона. В части случаев возможен переход острой левожелудочковой недостаточности в хроническую, что, по-видимому, связано с состоянием миокарда левого желудочка и объёмом регургитирующей крови.
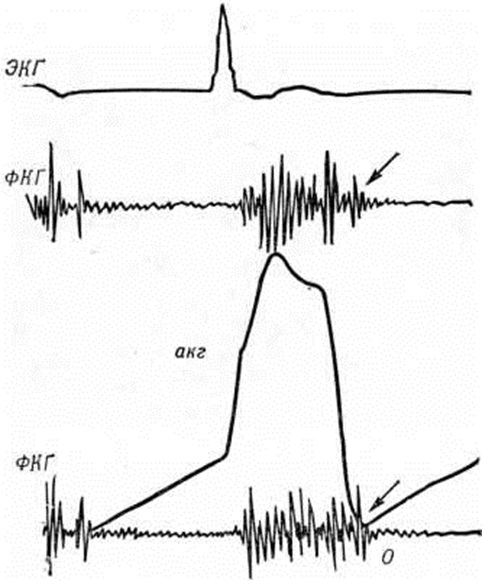
Пролапс митрального клапана не обязательно приводит к митральной недостаточности (баллонирование, выбухание створки митрального клапана). Жалобы больных в этих случаях связаны с патологический перерастяжением и, возможно, нарушением кровоснабжения папиллярной мышцы вследствие перегиба васкуляризирующей её артерии. Характерны длительные боли в области сердца, обычно без иррадиации, иногда усиливающиеся при нагрузке. В некоторых случаях боль возникает только при нагрузке и исчезает с её прекращением. Примерно V4 больных жалуется на перебои в работе сердца или приступы сердцебиения, чему объективно чаще всего соответствуют желудочковые нарушения ритма — экстр асистолия (смотри полный свод знаний), пароксизмальная тахикардия (смотри полный свод знаний), которые могут предшествовать внезапной смерти больных от фибрилляции желудочков (смотри полный свод знаний: Аритмии сердца).
 |
|  |
Рис. 6. | ||
 |
|  |
Рис. 10. | ||
При появлении митральной недостаточности, обусловленной пролапсом створок клапана, регургитация происходит, как правило, только во второй половине систолы и почти никогда не достигает значительной величины. Поэтому жалобы, отражающие гемодинамические расстройства, обычно отсутствуют. Объективные симптомы — смотри таблицу.
Осложнения. Перерастяжение левого предсердия может привести к нарушениям внутрипредсердной проводимости и развитию мерцательной аритмии (смотри полный свод знаний), при которой в растянутом предсердии легко образуются пристеночные тромбы. Даже при функционально полноценном миокарде появление мерцательной аритмии нередко приводит к сердечной недостаточности. Возможны тромбоэмболии в сосуды большого круга кровообращения (смотри полный свод знаний: Тромбоэмболия), стенокардия (смотри полный свод знаний), кровохарканье (смотри полный свод знаний). Последние осложнения наблюдаются реже, чем при митральном стенозе например, кровохарканье и стенокардия — в 2 раза реже. Но в отдельных случаях они являются первыми клинические, проявлениями порока. Чрезвычайное физическое напряжение может вести к возникновению отёка лёгких, который у больных с митральной недостаточностью наблюдается, по разным данным, в 8 раз реже, чем при митральном стенозе.
Одним из возможных осложнений митральной недостаточности ревматического происхождения, которое почти никогда не встречается при чистом митральном стенозе, является бактериальный эндокардит (смотри полный свод знаний: Эндокардит). Его развитие ведёт, как правило, к усилению регургитации (в частности, в связи с перфорацией створок митрального клапана) и служит нередкой причиной тромбоэмболических осложнений.
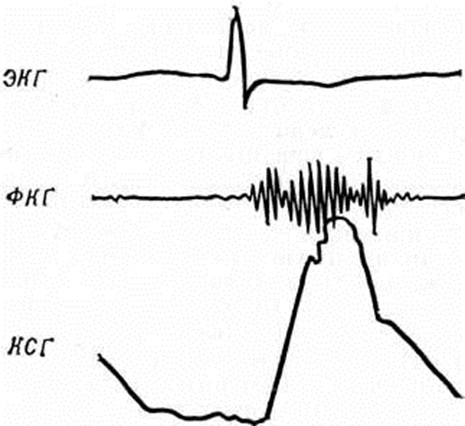
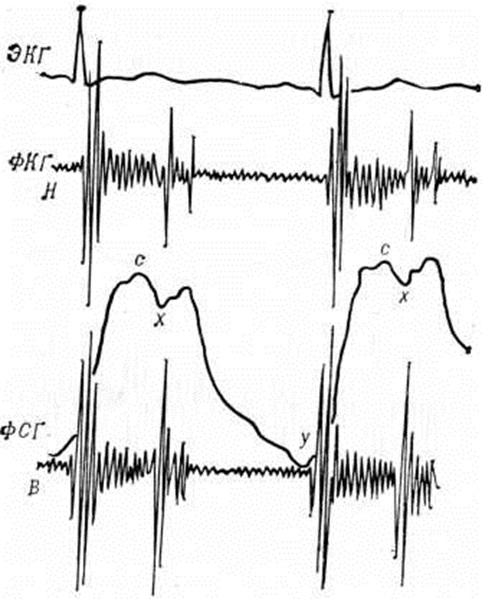
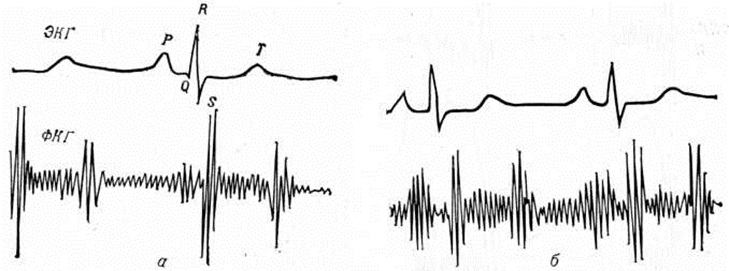
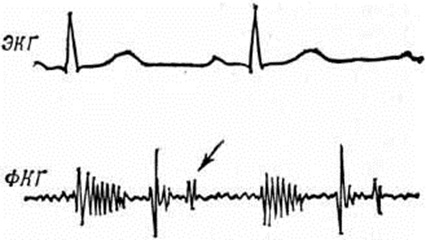
Диагноз недостаточности митрального клапана устанавливается по типичной аускультативной триаде (систолический шум и ослабление I тона на верхушке сердца, акцент II тона над лёгочным стволом), подтверждаемой на ФКГ (рисунок 6; на этом рисунке, а также на рисунок 8, 9, 11, 12, 16, 18, 20 ЭКГ при ведены в обычной для фонокардиографического исследования синхронной записи с ФКГ, необходимой для хронологического анализа последней), в сочетании с признаками гипертрофии и дилатации левых желудочка и предсердия, которые при хронический форме порока выявляются с помощью перкуссии и пальпации, рентгенологическое исследования (рисунок 7) и данных ЭКГ (смотри полный свод знаний: таблицу). Этиологического диагноз хронический митральной недостаточности нередко затруднён. В пользу ревматической природы заболевания свидетельствуют анамнестические указания на ревматизм (примерно у половины больных с ревматической митральной недостаточностью). Убедительный признак ревматической этиологии митральной недостаточности — наличие симптомов митрального стеноза. Возникновение изолированного порока в пожилом возрасте более характерно для атеросклеротической митральной недостаточности.
Диагноз острой митральной недостаточности при разрыве папиллярной мышцы или сухожильной хорды основывается на внезапном развитии симптомов лёгочного застоя вплоть до отёка лёгких при одновременном появлении аускультативных признаков порока, подтверждаемых на ФКГ (рисунок 8), и отсутствии гипертрофии левых отделов сердца. Систолический шум при острой форме развития порока может проводиться к основанию сердца; нередко появляется ритм диастолического галопа (в связи с усилением как III, так и IV тона сердца). У некоторых больных митральная недостаточность при разрыве хорды или папиллярной мышцы протекает в хронический форме и практически неотличима от ревматической митральной недостаточности.
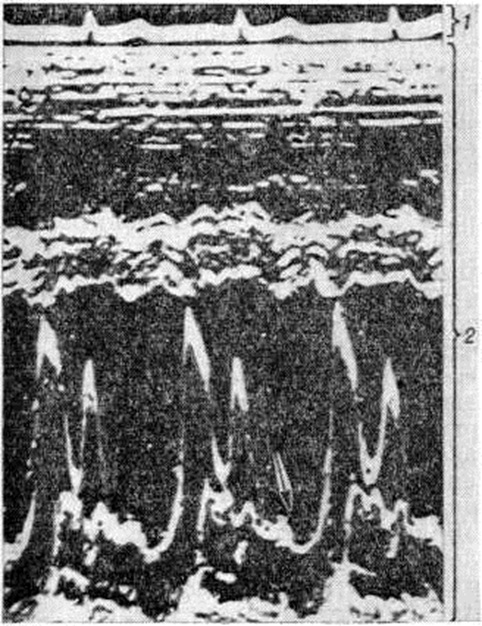
Диагноз пролапса створок митрального клапана предполагается при наличии мезосистолического щелчка и телесистолического шума, выявляемых на ФКГ (рисунок 9), но окончательно устанавливается с помощью эхокардиографии (рисунок 10) и других инструментальных методов (смотри полный свод знаний: таблицу).
Дифференциальный диагноз при отсутствии полной картины порока проводится чаще всего с состояниями, при которых выявляется систолический шум. Различия последнего с систолическим шумом при других Пороки сердца приобретённые выявляются путём топографической аускультации: шум при трикуспидальной недостаточности и стенозе устья аорты имеет иные точки максимального звучания на грудной клетке и пути проведения (смотри полный свод знаний: таблицу). Значительное усиление шума трикуспидальной недостаточности на высоте вдоха часто позволяет отличить его от шума митральной недостаточности. Систолический шум аортального стеноза усиливается после приёма под язык нитроглицерина и уменьшается после внутривенного введения небольшой дозы мезатона, а при митральной недостаточности под влиянием этих средств интенсивность шума изменяется в противоположном направлении. В сокращениях, следующих за компенсаторной постэкстрасистолической паузой, интенсивность шума аортального стеноза увеличивается, а шума митральной недостаточности — не меняется. Большое значение имеют данные ФКГ для установления характера шума и рентгенологическое исследование, с помощью которого довольно рано можно выявить признаки гипертрофии и дилатации отделов сердца, свойственные определённым Пороки сердца приобретённые Иногда дифференциальный диагноз возможен только при инвазивных исследованиях сердца (смотри полный свод знаний: Катетеризация сердца; Сердце, специальные методы исследования).
Большие трудности представляет иногда различение порока с относительной митральной недостаточностью, если последняя развивается у больных с тяжёлыми поражениями миокарда, значительным увеличением сердца и сердечной недостаточностью. Данные анамнеза, динамического наблюдения, клинических и инструментальных методов исследования в подобных случаях малоинформативны. Отсутствие анамнестических указаний на ревматизм имеет относительное значение и позволяет лишь предположить, что митральная недостаточность связана с другими причинами. В некоторых случаях только уменьшение проявлений митральной недостаточности в результате длительного интенсивного лечения недостаточности кровообращения склоняет к диагнозу относительной (функциональной) недостаточности клапана.
Стеноз левого атриовентрикулярного отверстия (митральный стеноз)
Ревматизм считается единственной причиной приобретённого митрального стеноза, хотя почти у половины больных не удаётся выявить ревматический анамнез. Этот порок примерно в 4 раза чаще встречается у женщин, чем у мужчин. Из всех поражений двустворчатого клапана изолированный митральный стеноз отмечается, по клинические, данным, почти в х/3 случаев, однако и в этих случаях при проведении митральной комиссуротомии нередко выявляется регургитация, свидетельствующая о наличии и недостаточности клапана.
Патогенез гемодинамических нарушений. Стеноз атриовентрикулярного отверстия создаёт высокое сопротивление потоку крови из левого предсердия в левый желудочек сердца. Если время диастолы не изменено, то для перемещения нормального объёма крови за диастолический период из предсердия в желудочек необходимо повышение градиента (т. е. разницы, перепада) давления между ними, пропорциональное четвертой степени уменьшения радиуса отверстия. При этом своевременное заполнение желудочка достигается ростом линейной скорости крови в суженном отверстии, особенно возрастающей в период систолы предсердий (перед систолой желудочков), что создаёт турбулентные потоки в зоне сужения и проявляется характерным для порока диастолическим шумом с пресистолическим (при синусовом ритме) его усилением. Величина требуемого повышения градиента давления зависит главным образом от степени стеноза, но она возрастает также с увеличением объёма перемещаемой крови (т. е. пропорциональна ударному объёму сердца) и при укорочении диастолы. В связи с этим величина градиента изменяется в широких пределах у одного и того же больного в зависимости от функциональной нагрузки на кровообращение и темпа сердечных сокращений.
Повышение предсердно-желудочкового градиента давления достигается гиперфункцией левого предсердия, степень которой ограничена малой массой миокарда предсердия. Возможность компенсации порока реальна, если площадь сечения левого атриовентрикулярного отверстия (в норме около 6 см²) уменьшается в 2 раза. При уменьшении её до 2,5 см² и менее компенсация порока обычно не достигается, а сужение отверстия до 1 см² считается критическим, ведущим, как правило, к частому развитию отёка лёгких (смотри полный свод знаний) при малых физических нагрузках. В то же время при медленном развитии порока, особенно в молодом возрасте, нередко отмечаются случаи многолетнего сохранения компенсированной гемодинамики при выраженном сужении отверстия.
Наличие митрального стеноза создаёт предпосылки для нарушений гемодинамики в двух направлениях: в большом круге кровообращения— в виде возможного снижения ударного объёма сердца (вследствие недостаточного заполнения левого желудочка сердца) и в малом круге кровообращения — в связи с ростом давления в левом предсердии. Если сердечный выброс у больных с небольшим митральным стенозом может оставаться в покое нормальным и адекватно увеличиваться в определённых пределах при физической нагрузке, то рост давления в левом предсердии, необходимый для создания тем большего градиента давления, чем больше стеноз, имеет место при любой степени стеноза даже в покое. Этим обусловлены практически обязательные при митральном стенозе (различаемые лишь по степени) изменения гемодинамики в малом круге кровообращения.
Рост давления в левом предсердии распространяется на лёгочные вены и достигает венозной части капилляров лёгкого, угрожая развитием отёка лёгких и способствуя диапедезу эритроцитов с возможным появлением элементов гемосидероза в лёгочных тканях. При значительном митральном стенозе выраженная венозная гипертензия малого круга кровообращения ведёт к расширению анастомозов между лёгочными и бронхиальными венами, создавая в стенках бронхов варикозные расширения вен, возможный разрыв которых может обусловить возникновение кровохарканья. Трофика бронхиальных стенок при этом нарушается (особенно при развитии недостаточности правого желудочка, способствующей отеку слизистой оболочки бронхов), что у некоторых больных проявляется склонностью к рецидивирующим бронхитам (смотри полный свод знаний).
Важное патогенетическое значение лёгочной венозной гипертензии при митральном стенозе состоит в вызываемой ею рефлекторной стойкой гипертонии артериол малого круга (рефлекс Китаева), которая из-за длительности этого компенсаторного процесса завершается их гипертрофией, создающей стойкую артериальную гипертензию малого круга кровообращения (смотри полный свод знаний) с высоким сопротивлением оттоку крови из лёгочного ствола. Этот феномен предохраняет лёгочные капилляры от перегрузки объёмом, снижая угрозу отёка лёгких, но имеет два важных дополнительных патофизиологические следствия. Во-первых, высокое сопротивление кровотоку в лёгочных артериолах ограничивает в конечном итоге приток крови к левому желудочку сердца, то есть уменьшает ударный объем сердца или, во всяком случае, препятствует его повышению по физиологический необходимости (так называемый второй барьер, если первым барьером считать само сужение атриовентрикулярного отверстия). Во-вторых, лёгочная артериальная гипертензия создаёт нагрузку сопротивлением на правый желудочек сердца, резко возрастающую при любом повышении объёма кровообращения, что ведёт к ранней и выраженной гиперфункции и гипертрофии желудочка (значительно более выраженной, чем при митральной недостаточности), а в последующем — к правожелудочковой сердечной недостаточности (смотри полный свод знаний).
Растяжение левого предсердия в условиях перенапряжения его функции (и, следовательно, метаболических процессов в нем) чаще и обычно раньше, чем при митральной недостаточности, приводит к появлению мерцательной аритмии, на фоне которой повышается вероятность тромбообразования в предсердиях, существующая при выраженном митральном стенозе даже без нарушений ритма (в связи с низкой скоростью перемещения пристеночных масс крови в растянутом левом предсердии, особенно в его ушке, а также в случае активного кардита).
Минутный объем кровообращения снижается, как правило, уже при умеренном митральном стенозе. С нарастанием степени стеноза уменьшается способность сердца реагировать адекватным увеличением сердечного выброса на физическую нагрузку; у некоторых больных с исходно низким сердечным выбросом он может не изменяться и даже снижаться при нагрузке. Последний феномен особенно заметен при развитии недостаточности правого желудочка, усугубляющейся даже малыми приростами объёма выброса, вследствие чего увеличивается работа на сопротивление в изменённых артериолах малого круга. Возникновение мерцательной аритмии дополнительно снижает сердечный выброс, что связано с утратой насосной функции левого предсердия и соответствующим снижением давления в его полости. Кроме того, резкое уменьшение количества крови, поступающей в левый желудочек во время короткой диастолы не компенсируется некоторым увеличением заполнения левого желудочка во время длинной диастолы.
Снижение сердечного выброса при митральном стенозе сопровождается компенсаторными сосудистыми реакциями, направленными на «централизацию» кровообращения (смотри полный свод знаний: выше) с ограничением кровоснабжения периферических тканей и органов (холодные конечности, мышечная утомляемость и слабость, снижение дневного диуреза и другие проявления сниженного периферического кровотока). При значительном снижении объёма кровообращения или при вынужденном перераспределении крови в работающие скелетные мышцы при физической нагрузке недостаточность кровоснабжения распространяется также на головной мозг и сердце, что может проявиться обмороками, быстрой утомляемостью при умственной работе, приступами стенокардии.
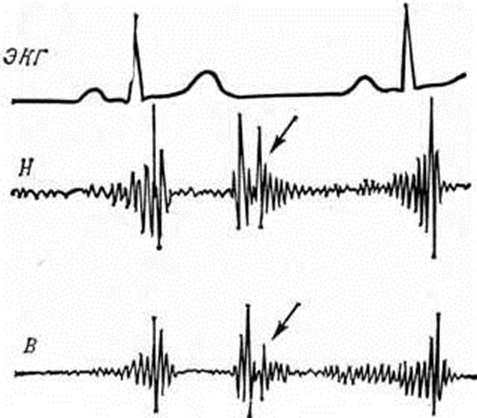
С уменьшением объёма наполнения левого желудочка связывалось образование громкого (хлопающего) I тона сердца при митральном стенозе. Генез этого симптома, как и патогномоничного для митрального стеноза «тона (щелчка) открытия митрального клапана», продолжает изучаться. Одна из косвенно подтверждаемых гипотез формирования этих симптомов принадлежит Холльдаку (К. Holldack) и соавторами, которые объясняют возникновение этих звуковых феноменов упругим прогибом воронки, образованной сращением створок клапана: во время систолы — в сторону предсердия (хлопающий звук I тона) и в начале диастолы — в сторону желудочка («тон открытия митрального клапана»). Именно поэтому, если стенки воронки становятся ригидными в результате обызвествления и разрастания грубой рубцовой ткани, исчезают оба эти звука. В случаях грубых подклапанных сращений (воронкообразный стеноз) в результате возникновения турбулентного движения крови на этом участке при систоле желудочка формируется систолический шум, который может быть иногда единственным шумом при изолированном митральном стенозе (так называемый систолический вариант митрального стеноза).
Клинические проявления и течение. Развитие клинические, проявлений может быть постепенным, начиная с жалоб больного на общую утомляемость, слабость, боли в области сердца, ощущение сердцебиения и одышки при физической нагрузке, перебои в работе сердца, кашель, кровохарканье. Однако нередко первыми проявлениями порока сердца служат его осложнения — мерцательная аритмия, острый отёк лёгких или симптомы, связанные с инфарктом лёгких или эмболией в артерии большого круга кровообращения.
Чаще больные жалуются на одышку (смотри полный свод знаний), которая вначале возникает лишь при значительной нагрузке, а в дальнейшем появляется и при небольших напряжениях и, наконец, в покое, приобретая характер ортопноэ. В этот период после нагрузки, волнения, а также ночью могут возникать приступы «митральной астмы», которая, в отличие от обычной сердечной астмы (смотри полный свод знаний), обусловлена не левожелудочковой, а левопредсердной недостаточностью. Обычно приступ удушья удаётся быстро купировать или он проходит самостоятельно. Отёк лёгких (смотри полный свод знаний) может развиваться у больных митральным стенозом, особенно на сравнительно ранней стадии заболевания как естественное продолжение приступа «митральной астмы». В неблагоприятных условиях отёк лёгких у отдельных больных может возникать несколько раз в день, представляя каждый раз реальную угрозу для жизни больного. Иногда отёк лёгких развивается в момент возникновения мерцательной тахиаритмии (смотри полный свод знаний: Мерцательная аритмия).
Боли в области сердца и в грудной клетке отмечаются часто и могут носить различный характер. Особенно характерными считают тупые длительные боли, локализующиеся в межлопаточной области слева (точка Вакеза) и усиливающиеся при нагрузке. Подобные боли наблюдаются при большом увеличении левого предсердия; боль усиливается при надавливании в точке Вакеза. У 10—20% больных боль по характеру неотличима от боли при стенокардии (смотри полный свод знаний).
Кровохарканье наблюдается у 10— 15% больных с митральным стенозом и может быть вызвано различными причинами. Вариант течения болезни, при котором повторные кровохарканья становятся одним из ведущих её проявлений, С. С. Зимницкий называл псевдотуберкулёзной формой митрального стеноза. В таких случаях кровохарканье обусловлено так называемый апоплексией лёгких, которую связывают с разрывом варикозно-расширенных сосудов в зоне анастомозов между лёгочными и бронхиальными венами.
Объективные признаки стеноза левого атриовентрикулярного отверстия — смотри таблицу.
Митральный стеноз относится к числу наиболее неблагоприятно протекающих Пороки сердца приобретённые, нередко быстро прогрессирует, рано декомпенсируется. По специальным наблюдениям за больными, они доживали в среднем до 40—45 лет и только 20—25% больных переживали возраст 50 лет. Лишь небольшая часть больных, чаще женщин, на протяжении многих лет сохраняет состояние полной компенсации кровообращения; эти женщины благополучно переносят беременность, доживают до старческого возраста.
Осложнения. Кроме недостаточности кровообращения, протекающей по типу правожелудочковой сердечной недостаточности и отёка лёгких, нередко составляющих существенную часть клинические, проявлений декомпенсированного порока, к числу наиболее частых осложнений митрального стеноза относится мерцательная аритмия (смотри полный свод знаний). Установлению постоянной формы мерцания предсердий могут предшествовать несколько пароксизмов, однако нередко, впервые возникнув, она уже не прекращается самостоятельно. В момент возникновения мерцательной аритмии обычно развивается одышка, «митральная астма», отёк лёгких, резкая слабость, головокружение или синкопальное состояние (смотри полный свод знаний: Обморок).
Эмболии в артерии большого круга кровообращения наблюдаются у 10—20% больных с ревматическим поражением митрального клапана, причём, по разным данным, частота их при митральном стенозе и митральной недостаточности почти одинакова; в то же время отмечено, что частота артериальных эмболий при мерцательной аритмии в 3—5 раз выше, чем при синусовом ритме. Примерно в 3/4 случаев эмболия отмечается в сосуды головного мозга, реже в сосуды селезёнки, почек и мезентериальные артерии (смотри полный свод знаний: Эмболия). Довольно редким проявлением заброса мельчайших эмболов в сосуды головного мозга бывает «сердечная» эпилепсия; ещё реже эмболия служит причиной инфаркта миокарда (смотри полный свод знаний). Эмболические инфаркты почек могут быть причиной артериальной гипертензии. Эмболии часто носят повторный характер.
Источником артериальных эмболий являются тромбы, образующиеся в левом предсердии (смотри полный свод знаний: выше). Тромб (смотри полный свод знаний) может постепенно увеличиваться, ухудшая гемодинамику, может отслоиться от стенки предсердия и приобрести подвижность (шаровидный тромб). В последнем случае возникает опасность внезапной, чаще преходящей, закупорки суженного левого атриовентрикулярного отверстия, сопровождающейся синкопе, или «состоянием медленного умирания в течение 1—2 дней... при бурной деятельности сердца наряду с отсутствием пульса» (В. X. Василенко, 1962). В поздних стадиях митрального стеноза может образоваться тромб в растянутом правом желудочке; нередко наблюдается также тромбообразование в венах ног на почве хронический застоя, создающее опасность эмболии лёгочной артерии (смотри полный свод знаний) и инфаркта лёгких (смотри полный свод знаний). Последний, по некоторым представлениям, может быть связан также с формированием тромба непосредственно в артериях лёгких.
Профузное лёгочное кровотечение (смотри полный свод знаний), требующее экстренной митральной комиссуротомии, относится к редким осложнениям митрального стеноза. Как и обильное кровохарканье, оно обычно является следствием апоплексии лёгких, которая может быть спровоцирована физической нагрузкой и другими причинами возрастания объёма кровообращения (беременность, лихорадка).
Примерно у 25% больных с митральным стенозом наблюдается рецидивирующий бронхит, сопровождающийся в ряде случаев выделением мокроты с примесью крови.
Диагноз. При типичных проявлениях митрального стеноза диагноз может быть легко установлен без дополнительных методов обследования больного по характерным жалобам, наличию facies mitralis и аускультативному выявлению «ритма перепела», наблюдающегося в связи с наличием «тона открытия митрального клапана» только при митральном стенозе (смотри полный свод знаний: таблицу). При синусовом ритме специфическое диагностическое значение имеет пресистолическое усиление диастолического шума и усиленный, или хлопающий, I тон сердца. Все эти феномены хорошо выявляются на ФКГ (рисунок 11). Выявлению «тона открытия митрального клапана» помогает запись апекскардиограммы (смотри полный свод знаний: Кардиография), синхронная с ФКГ (рисунок 12). При сомнительных аускультативных данных правильному диагнозу способствуют рентгенологическое обнаружение увеличенного левого предсердия и признаков лёгочной гипертензии (рисунок 13) или застоя (рисунок 14), а также выявление «тона открытия митрального клапана» на ФКГ и сочетание признаков гипертрофии правого желудочка и Р mitrale на ЭКГ. Особенно труден диагноз митрального стеноза при «афоническом» пороке, когда в связи с грубыми рубцовыми изменениями в зоне клапана или образованием внутри-предсердных тромбов исчезают типичные аускультативные феномены. В таких случаях наличие митрального стеноза устанавливают путём тщательной дифференциальной диагностики с другими Пороки сердца приобретённые и различными заболеваниями сердца нередко лишь по данным инвазивных методов исследования (смотри полный свод знаний: таблицу).
Дифференциальный диагноз наиболее трудно провести с миксомой левого предсердия — своеобразной псевдоопухолью, периодически закрывающей левое атриовентрикулярное отверстие (смотри полный свод знаний: Сердце, опухоли), что может дать картину, почти неотличимую по проявлениям от митрального стеноза. О наличии миксомы свидетельствуют резкое изменение аускультативной картины при перемене положения тела больного, а также наличие анемии, стойкого субфебрилитета, нарастающего похудания и гиперглобулинемии. Чаще всего окончательный диагноз устанавливается на основе данных эхокардиографии или лёгочной артериографии и подтверждается данными операции, однако во многих случаях миксома остаётся нераспознанной.
Синдром, сходный с клинические, картиной ревматического митрального стеноза, наблюдается также при «наружном митральном стенозе» — анулярном варианте констриктивного перикардита (смотри полный свод знаний) с образованием фиброзно-известкового обруча по ходу атриовентрикулярной борозды. В подобных случаях обычно удаётся выявить анамнестические указания на перикардит; рентгенологическое исследование выявляет кольцевидное фрагментарное обызвествление на наружной поверхности сердца или плевроперикардиальные спайки; эхокардиографические признаки истинного митрального стеноза отсутствуют.
Некоторые признаки митрального стеноза встречаются также при отдельных врождённых пороках сердца. При наличии у взрослых дефекта межпредсердной перегородки иногда выслушивается шум относительного сужения правого предсердно-желудочкового отверстия и раздвоение II тона в точке Боткина — Эрба (смотри полный свод знаний: Сердце, методы исследования), которое может быть ошибочно принято за «тон открытия митрального клапана». Отсутствие рентгенологическое признаков увеличения левого предсердия, данные электрокардиографического исследования и эхокардиографии способствуют уточнению диагноза. При более редком врождённом пороке сердца — так называемый трёхпредсердном сердце (наличие в левом предсердии перегородки с отверстиями, отделяющей область впадения лёгочных вен от области митрального клапана) — препятствие кровотоку в левом предсердии может быть причиной симптомов, характерных для митрального стеноза,— кровохарканье, одышка, сердечная астма и отёк лёгких, гипертрофия правого желудочка, по данным ЭКГ, его увеличение и венозный застой в лёгких по рентгенологическое данным. Однако типичная аускультативная симптоматика митрального стеноза отсутствует; рентгенологическое исследование не выявляет увеличения левого предсердия. Эхокардиография (смотри полный свод знаний) позволяет лоцировать дополнительные сигналы в полости левого предсердия, отражённые от врождённой перегородки; признаки митрального стеноза отсутствуют. Диагноз окончательно устанавливается с помощью лёгочной артериографии.
При систолическом варианте митрального стеноза выявление грубого систолического шума может быть причиной ошибочной диагностики митральной недостаточности. Подобные ошибки могут возникать и при наличии систолического шума, обусловленного относительной трикуспидальной недостаточностью или относительным стенозом устья лёгочного ствола, резко расширенного вследствие высокой лёгочной гипертензии. Правильному диагнозу в этих случаях помогает отсутствие гипертрофии левого желудочка сердца, но нередко окончательная верификация диагноза чистого митрального стеноза может быть осуществлена только с помощью инвазивных методов исследования (измерение давления в полостях сердца и контрастирование его полостей).
Гипердинамия сердца, и в частности предсердий, наблюдающаяся при тиреотоксикозе (смотри полный свод знаний), может быть причиной усиления I тона, появления нежного диастолического шума на верхушке сердца и пароксизмов мерцательной аритмии, которые ошибочно могут быть приняты за признаки митрального стеноза. Дифференциальный диагноз проводится на основе других клинические, признаков тиреотоксикоза, исследования поглощения 131I щитовидной железой, определения концентрации в крови её гормонов и данных эхокардиографического исследования.
В некоторых случаях приходится проводить дифференциальную диагностику между митральным стенозом и хронический лёгочным сердцем (смотри полный свод знаний). Такая необходимость возникает в случае осложнения митрального стеноза рецидивирующим бронхитом, с которым ошибочно связывается лёгочная гипертензия, особенно если из-за анатомических особенностей порока исчезает «тон открытия митрального клапана». Уточнению диагноза способствует обнаружение при рентгенологическое исследовании увеличенного левого предсердия, кальцификации клапана, венозного застоя в лёгких. Большое дифференциально-диагностическое значение имеют данные эхокардиографического исследования.
Сочетанный митральный порок сердца (митральная болезнь)
Сочетанный митральный порок, то есть наличие митрального стеноза и митральной недостаточности, отмечается значительно чаще, чем изолированные эти пороки, и всегда имеет ревматическую этиологию. Почти всегда ревматическое поражение митрального клапана приводит к сочетанному пороку, поэтому наиболее частая задача при диагностике митрального порока у больных ревматизмом состоит в установлении преобладания у данного больного стеноза или недостаточности, что не всегда удаётся.
Патогенез гемодинамических нарушений при сочетанном митральном пороке в значительной мере зависит от соотношения степени стеноза атриовентрикулярного отверстия и степени недостаточности митрального клапана, но их обычно отягощают нарушения внутрисердечной гемодинамики, так как снижение заполнения левого желудочка обусловлено и сужением отверстия, и регургитацией крови, а гиперфункция предсердия осуществляется на нагрузку как сопротивлением, так и объёмом.
Если умеренный митральный стеноз (площадь отверстия 2—3 см²) сочетается с выраженной ригидностью створок митрального клапана, то возможна значительная желудочково-предсердная регургитация крови, позволяющая говорить о преобладании митральной недостаточности над стенозом. Однако в период заполнения левого желудочка к концу систолы в результате перерастяжения предсердия большим объёмом крови создаётся гемодинамически значимый блок на уровне митрального клапана, и, несмотря на преобладание митральной недостаточности, заболевание клинически протекает как митральный стеноз. Такое же течение характерно для выраженного стеноза, сочетающегося с небольшой митральной недостаточностью. Лишь при сочетании очень небольшого сужения левого атриовентрикулярного отверстия с выраженной митральной недостаточностью в клинические, картине преобладают черты последней.
Клинические проявления и течение. Симптомы сочетанного митрального порока сердца сходны с проявлениями изолированных митрального стеноза и митральной недостаточности. Они могут начинаться постепенно с жалоб больных на одышку при физическом напряжении, на боли в области сердца, иногда имеющие ангинозный характер (особенно после развития выраженных гемодинамических нарушений), сердцебиения, ощущение перебоев в работе сердца. Но нередко первыми проявлениями гемодинамических расстройств служат, как и при изолированных стенозе и недостаточности, осложнения этих пороков — отёк лёгких, кровохарканье, тромбоэмболии, мерцательная аритмия. Постепенно развивается обструктивное поражение мелких артерий и артериол лёгких, ведущее к выраженному повышению давления в правом желудочке и правожелудочковой недостаточности.
Диагноз сочетанного митрального порока сам по себе обычно не труден, так как основывается на одновременном наличии симптомов митрального стеноза и митральной недостаточности (диастолический и систолический шум, гипертрофия правого и левого желудочков и так далее). Наибольшие трудности в диагнозе представляет определение преобладания стеноза отверстия или недостаточности клапана. Иногда чёткого преобладания той или другой формы порока нет, и важно помнить, что сочетание выраженного митрального стеноза с тяжёлой митральной недостаточностью невозможно, поскольку резко суженное левое атриовентрикулярное отверстие при наличии выраженной деформации створок митрального клапана создаёт большое сопротивление обратному току крови из левого желудочка в левое предсердие.
Было предпринято немало попыток чётко сформулировать признаки различной степени преобладания сужения левого предсердно-желудочкового отверстия или недостаточности митрального клапана. По данным Б. В. Петровского, при сочетании умеренного стеноза с выраженной недостаточностью, объективные признаки конвергируют с признаками митральной недостаточности. Из «мелодии» митрального стеноза сохраняется лишь протодиастолический шум (пресистолический компонент сохраняется редко, так как в подобных случаях обычно отмечается мерцательная аритмия); наблюдается усиление III тона сердца. Другие клиницисты, например Шаффер и Зильбер (Shaffer, Silber, 1973), считают, что такая картина более характерна для преобладания стеноза, а при сочетании выраженного стеноза с небольшой недостаточностью — развёрнутая картина митрального стеноза дополняется систолическим шумом на верхушке сердца. Имеется несовпадение мнений о критериальном значении клинические, симптомов и при других соотношениях степени стеноза и недостаточности.
Дополнительную информацию позволяют получить инструментальные методы исследования. На электрокимограмме левого предсердия (смотри полный свод знаний: Электр окимография) при преобладании недостаточности митрального клапана зубцы приобретают форму желудочковых из-за выраженной регургитации крови, а при преобладании стеноза зубец регургитации лишь намечается. Признаки гипертрофии левого желудочка на ЭКГ при преобладании митрального стеноза отсутствуют или минимальны, тогда как при преобладании недостаточности нередко достигают значительной выраженности. Эхокардиографически при преобладании митральной недостаточности полость левого желудочка значительно увеличена, отмечается более выраженная, чем при преобладании стеноза, гиперкинезия его стенок; значительно расширена полость левого предсердия. Выявляется увеличенная экскурсия, а иногда и сепарация створок митрального клапана, а также их конкордантное движение в фазу диастолы. Однако и инструментальные данные не всегда позволяют получить чёткое представление об истинном характере порока.
Установление преобладания недостаточности клапана или стеноза может быть сложным даже при использовании инвазивных методов диагностики. Например, такой кардинальный признак митрального стеноза, как высокий градиент давления между левым предсердием и левым желудочком, может быть невыраженным при гипотоничном, резко растянутом предсердии и при недостаточности левого желудочка с ростом в нем диастолического объёма (при снижении сердечного выброса). Напротив, даже при чистой митральной недостаточности с выраженной атриомегалией возможно возникновение градиента давления за счёт функционального стеноза. Тем не менее сопоставление данных внутриполостной манометрии (смотри полный свод знаний: Внутрисердечное давление) с данными внутриполостного рентгеноконтрастного исследования (смотри полный свод знаний: Ангиокардиография) в подавляющем большинстве случаев позволяет с достаточной степенью точности определить характер поражения митрального клапана, что имеет исключительное значение при определении показаний к хирургическому лечению и самого характера вмешательства (комиссуротомия или протезирование).
Дифференциальный диагноз в ряде случаев приходится проводить с теми же заболеваниями, что и при изолированных митральном стенозе или митральной недостаточности.
Недостаточность аортального клапана (аортальная недостаточность)
Изолированная аортальная недостаточность у мужчин встречается, по данным Б. А. Черногубова (1950), в 10 раз чаще, чем у женщин. Наиболее частой причиной аортальной недостаточности, особенно у молодых мужчин, является ревматизм. Среди других причин порока имеют значение атеросклероз, подострый бактериальный эндокардит (чаще поражаются уже изменённые клапаны), редко травма. Сифилитический мезаортит (смотри полный свод знаний: Аортит) со второй половины 20 век утратил прежнее этиологического значение в связи с созданием эффективных мер лечения и профилактики сифилиса (смотри полный свод знаний). Кроме того, как и при аневризме аорты (смотри полный свод знаний), аортальная недостаточность сифилитической этиологии в большей степени относительная, так как собственно створки клапана изменяются мало. Причиной относительной аортальной недостаточности может быть также тяжёлая стабильная артериальная гипертензия (смотри полный свод знаний: Гипертензия артериальная).
При травме, остром и подостром септическом эндокардите, расслаивающей аневризме аорты аортальная недостаточность развивается остро. При ревматизме она имеет, как правило, постепенное развитие.
Патогенез гемодинамических нарушений. Основное следствие недостаточности аортального клапана — диастолическая регургитация крови из аорты в левый желудочек сердца, в результате которой желудочек испытывает дополнительную нагрузку объёмом, а напряжение стенок аортальной камеры соответственно снижается. Максимальная регургитация наблюдается в самом начале диастолы (когда давление в аорте ещё достаточно для преодоления сопротивления в зоне дефекта клапана). Именно в этот период турбулентное движение крови по краям дефекта создаёт аускультируемый шум (протодиастолический шум аортальной недостаточности).
Объем регургитации зависит от площади отверстия, через которое осуществляется ретроградный кровоток. Значительная регургитация наблюдается уже в тех случаях, когда эта площадь в 6 раз меньше площади полностью открытого устья аорты. Это связано с большим градиентом давления между аортой и полостью левого желудочка в фазу диастолы. При тяжёлой аортальной недостаточности из-за большого объёма регургитации давление в аорте круто падает и к концу диастолы стремится к нулю, что ведёт к исчезновению периода изоволюмического напряжения левого желудочка (гидродинамически объединённого в этих условиях с аортой в единую камеру) и исчезновению (или даже смене направления) градиента давления между аортальной камерой и капиллярами. Вследствие этого поступление крови в капилляры происходит главным образом в период систолы сердца (когда давление в аорте вновь повышается) и имеет пульсирующий характер. Этим объясняется ряд так называемый периферических симптомов аортальной недостаточности (смотри полный свод знаний: таблицу) и целесообразность компенсаторного учащения сердечных сокращений при этом пороке, которое ведёт к укорочению диастолы, то есть времени низкого кровотока в тканях.
При остром возникновении аортальной недостаточности массивная регургитация крови из аорты в плохо растяжимый левый желудочек ведёт к значительному повышению давления в его полости в середине и конце диастолы. В результате возникает инвертированный градиент давления между левым желудочком и левым предсердием, что ведёт к преждевременному закрытию митрального клапана. Этот механизм в течение какого-то времени предотвращает повышение давления в левом предсердии и развитие венозной гипертензии в лёгких. Однако в связи с внезапностью изменений гемодинамических условий при тяжёлой острой аортальной недостаточности не успевает развиться гипертрофия левого желудочка; он дилатируется, что приводит к относительной недостаточности митрального клапана, дополняющей перегрузку левого желудочка, в связи с чем рано развивается левожелудочковая недостаточность.
При хронический аортальной недостаточности конечное диастолическое давление в полости левого желудочка может длительное время оставаться нормальным, что объясняют постепенным увеличением растяжимости миокарда левого желудочка. Однако с истощением резервных возможностей гиперфункционирующего левого желудочка диастолическое давление в нем повышается, и возможно развитие относительной митральной недостаточности, ведущей к повышению давления в полости предсердия и лёгочных венах, а затем в сосудах системы лёгочной артерии и правом желудочке.
Сердечный выброс при аортальной недостаточности может оставаться нормальным в течение многих десятилетий благодаря тому, что левый желудочек является самой мощной камерой сердца и его увеличенное диастолическое кровенаполнение, ведущее, согласно закону Старлинга (смотри полный свод знаний: Старлинга закон), к усилению сокращений, вызывает постепенное развитие гипертрофии миокарда. В поддержании сердечного выброса на нормальном уровне имеют значение и такие факторы, как удлинение времени систолического изгнания. Важное значение в поддержании работоспособности сердца имеет при значительной регургитации и сдвиг максимального коронарного кровотока из диастолы в систолу, что позволяет поддерживать его на достаточном уровне, несмотря на низкое перфузионное диастолическое давление. При развитии левожелудочковой недостаточности сердечный выброс уменьшается. При этом в связи с повышением диастолического давления в левом желудочке уменьшается и объем регургитирующей крови, в результате чего физикальные признаки аортальной недостаточности могут смягчаться и даже исчезать.
Экспериментальные и клинические данные показывают, что большую роль в формировании гемодинамических особенностей аортальной недостаточности играет величина общего периферического сопротивления кровотоку. Снижение общего периферического сопротивления, в частности при вдыхании амилнитрита, ведёт к повышению выброса крови в аорту и уменьшению регургитации; повышение периферического сопротивления ведёт к противоположным результатам. Поэтому наблюдающееся при аортальной недостаточности снижение общего периферического сопротивления следует оценивать как компенсаторный процесс.
Клинические проявления и течение. При острой тяжёлой аортальной недостаточности симптоматика прогрессирует на протяжении нескольких дней, недель или месяцев. Больные с постепенно сформировавшейся аортальной недостаточностью могут не предъявлять никаких жалоб в течение многих десятилетий, несмотря на наличие выраженной регургитации. Одной из ранних жалоб бывает жалоба на сердцебиение или ощущение сотрясения грудной клетки, особенно в положении лёжа на левом боку; эти ощущения связаны с гипердинамией левого желудочка. Часто больных беспокоит головокружение при перемене положения тела, связанное с быстрым и существенным изменением перфузионного давления головного мозга.
Стенокардия (смотри полный свод знаний) наблюдается более чем у 50% больных с чистой аортальной недостаточностью ревматического и атеросклеротического генеза; ещё чаще она отмечается у больных с аортальной недостаточностью, вызванной сифилитическим мезаортитом. Наряду со стенокардией напряжения нередко отмечаются приступы стенокардии покоя, возникающие ночью и характеризующиеся повышением АД, синусовой тахикардией, одышкой и повышенным потоотделением.
Объективные признаки недостаточности клапана аорты — смотри таблицу.
Начало декомпенсации сердца проявляется одышкой при физическом напряжении, которая наряду с ощущениями сердцебиения, стенокардией, утомляемостью может многие годы оставаться умеренной, особенно при правильном лечении и при ограничении физической активности. Однако нередко с началом декомпенсации порока левожелудочковая недостаточность нарастает стремительно. Наиболее неблагоприятно течение аортальной недостаточности при остро возникающем пороке (травма, отрыв или перфорация заслонки аортального клапана при септическом эндокардите и тому подобное). С появлением приступов сердечной астмы или отёка лёгких (смотри полный свод знаний) больные весьма рефрактерны к консервативному лечению. Поэтому уже первый приступ сердечной астмы (смотри полный свод знаний) или развитие первого отёка лёгких вследствие декомпенсации порока (но не вследствие активного кардита, интоксикации и так далее), а также острое развитие выраженной аортальной недостаточности служат обычно показанием к оперативному вмешательству (протезирование аортального клапана), которое не следует откладывать (смотри полный свод знаний: Протезирование клапанов сердца).
Осложнения. Наиболее грозным осложнением аортальной недостаточности является отёк лёгких, развивающийся как проявление левожелудочковой сердечной недостаточности (смотри полный свод знаний). Иногда наблюдается желудочковая экстр асистолия (смотри полный свод знаний); очень редко причиной смерти больных бывает фибрилляция желудочков. Другие тяжёлые осложнения менее характерны. При медленном развитии декомпенсации аортальная недостаточность часто приводит к развитию относительной недостаточности митрального клапана и относительному стенозу левого атриовентрикулярного отверстия (митрализация аортального порока). Однако и в этих случаях возникновение типичных для митрального порока тромбоэмболических осложнений не характерно, если порок не осложняется бактериальным эндокардитом, присоединение которого увеличивает и степень аортальной недостаточности.
Диагноз выраженной аортальной недостаточности, как правило, не представляет трудностей. Даже при незначительной регургитации удаётся выявить дующий высокочастотный диастолический шум (смотри полный свод знаний: Сердечные шумы), начинающийся сразу вслед за II тоном, имеющий затухающий к концу диастолы характер в точке Боткина — Эрба; периферические признаки аортальной недостаточности (смотри полный свод знаний: таблицу) при этом могут отсутствовать. С увеличением степени регургитации интенсивность шума усиливается, появляются типичные периферические симптомы, характерные рентгенологическое признаки порока (смотри полный свод знаний: таблицу), в том числе данные рентгенокимограммы сердца (рисунок 15). При митрализации порока и ослаблении симптомов аортальной недостаточности в связи с сердечной недостаточностью (когда ослабевает и протодиастолический шум) диагноз становится сложным, если отсутствуют данные предварительных наблюдений. В подобных случаях аускультативная картина порока сердца сверяется с данными ФКГ (рисунок 16) и оценивается в динамике, так как она может в некоторой степени восстановиться после длительного пребывания больного на постельном режиме и энергичного лечения сердечной недостаточности.
 |
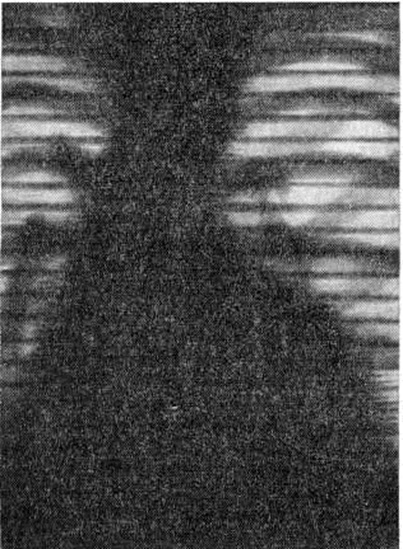
|  |
Рис. 15. | ||
Нередко, как и при митральной недостаточности, бывает трудно установить этиологического диагноз порока, так как выявление ревматизма в анамнезе значительно отстаёт по частоте от случаев порока, имеющего ревматическое происхождение. При собирании анамнеза следует обращать внимание на внесуставные проявления ревматизма в детстве, в частности на хорею (смотри полный свод знаний). Формирование порока у лиц пожилого возраста, особенно при наличии незначительной или умеренной регургитации и крайне медленном прогрессировании процесса, позволяет думать о его атеросклеротическом генезе. Всегда следует помнить о возможности бактериального эндокардита (смотри полный свод знаний: Эндокардит), который может осложнять течение ревматического порока сердца, поражать аномальный двустворчатый аортальный клапан или быть самостоятельной причиной его недостаточности. Когда формирование порока сопровождается выраженным расширением аорты, неврологический симптоматикой (смотри полный свод знаний: Аргайлла Робертсона синдром) и выявляются положительные серологические реакции (смотри полный свод знаний: Вассермана реакция, Кана реакция, Нелсона — Мейера реакция), диагностируется сифилитическая природа аортальной недостаточности. Острое развитие аортальной недостаточности требует проведения дифференциальной диагностики между септическим эндокардитом (смотри полный свод знаний), травмой сердца (смотри полный свод знаний) и расслаивающей аневризмой аорты (смотри полный свод знаний: Аневризма расслаивающая), что, как правило, не представляет трудностей.
Дифференциальный диагноз между аортальной недостаточностью и другими патологический состояниями редко оказывается необходимым. К подобным состояниям относится прежде всего незаращение артериального (боталлова) протока (смотри полный свод знаний: Артериальный проток), реже другие крупные центрально расположенные артериовенозные шунты. В подавляющем большинстве случаев характер шума и его локализация позволяют поставить правильный диагноз. Необходимость в зондировании полостей сердца обычно возникает лишь при определении показаний к оперативному вмешательству.
Стеноз устья аорты (аортальный стеноз)
Стеноз устья аорты, или аортальный стеноз, не относится к редким порокам сердца. Однако в половине случаев регистрируется расхождение клинических и патологоанатомических данных, что дало В. X. Василенко (1972) основание писать: «Стеноз устья аорты не столько редко встречается, сколько редко распознается». Бейли (Ch. P. Bailey, 1955) выявил стеноз устья аорты у 22,5% больных, оперированных по поводу Пороки сердца приобретённые, однако изолированным он бывает редко. У мужчин этот порок сердца наблюдается в 2,4 раза чаще, чем у женщин.
В отличие от врождённого аортального стеноза (смотри полный свод знаний: Пороки сердца врождённые), который может быть подклапанным, клапанным или надклапанным, приобретённый аортальный стеноз всегда носит клапанный характер. Наиболее частой причиной приобретённого аортального стеноза является ревматизм. Редкой причиной аортального клапанного стеноза является образование сращений между клапанными заслонками после излечения бактериального эндокардита. Не вполне ясна этиология идиопатического аортального стеноза, характерными чертами которого является изолированный характер клапанного поражения и кальциноз заслонок аортального клапана (порок Менкеберга). Высказывается предположение, что в генезе этого порока у молодых людей этиологического роль играет ревматизм, а у пожилых — атеросклероз. Есть также данные, что кальциноз поражает аортальный клапан преимущественно при врождённом сужении устья аорты или при другой врождённой аномалии — двустворчатом аортальном клапане. Ряд исследователей считает этиологию порока Менкеберга невыясненной.
Так называемый относительный стеноз аорты характеризуется возникновением систолического шума в проекции аортального клапана обычно вследствие расширения полостей аорты над клапаном и желудочка под клапаном; сужения клапанного отверстия при этом нет.
Патогенез гемодинамических нарушений. Сопротивление кровотоку в суженном устье аорты создаёт условия, при которых своевременное изгнание ударного объёма крови в аорту возможно лишь путём гиперфункции левого желудочка сердца. Преодоление дополнительного сопротивления достигается созданием в систоле более высокого, чем в норме, градиента давления между камерой желудочка и аортой: частично (и не во всех случаях) за счёт компенсаторного снижения давления в аорте, но главным образом вследствие роста давления в желудочке за счёт повышенного систолического напряжения его стенок, ведущего к ранней гипертрофии желудочка. Ощутимо повышенный градиент давления возникает лишь при уменьшении площади аортального отверстия до 1/3— ¼ нормальной величины. При этом в зоне суженного и деформированного устья аорты возрастает линейная скорость кровотока, что порождает турбулентные течения, с которыми связано возникновение характерных для аортального стеноза систолического шума изгнания и систолического дрожания. При значительном аортальном стенозе создание внутри-желудочкового давления, достаточного для полной компенсации дополнительной нагрузки сопротивлением, становится невозможным; в результате скорость изгнания крови из желудочка снижается, фаза изгнания удлиняется.
Величина градиента давления возрастает пропорционально увеличению степени сужения, ударного объёма и уменьшается с увеличением продолжительности фазы изгнания крови из левого желудочка, которое может иметь, таким образом, компенсаторный характер. При выраженном аортальном стенозе градиент давления может превышать 100 миллиметров ртутного столба. Удлинение фазы изгнания крови из левого желудочка приводит к тому, что эта фаза становится более продолжительной, чем фаза изгнания правого желудочка (в физиологический условиях эти соотношения носят обратный характер). В результате аортальный компонент II тона не предшествует лёгочному, а следует за ним, причём интервал между ними не увеличивается при задержке дыхания на высоте вдоха, как обычно, а уменьшается (парадоксальное расщепление II тона).
Степень гипертрофии миокарда зависит от тяжести стеноза и длительности его существования. Выраженная гипертрофия левого желудочка ведёт к уменьшению диастолической растяжимости его стенок и повышению диастолического давления в его полости (при аортальном стенозе оно не служит признаком левожелудочковой недостаточности), что приводит к увеличению силы сокращения левого предсердия (согласно закону Старлинга, в связи с увеличением начального напряжения миокарда левого предсердия). Поскольку стенки желудочка малоподатливы, кривая давления в левом предсердии представлена высокой основной волной, а на кривой внутрижелудочкового давления возникает теледиастолический предсердный подскок. В связи с небольшой продолжительностью систолы левого предсердия среднее давление в его полости и соответственно венозное давление в лёгких практически не повышаются до времени декомпенсации порока. Начало декомпенсации порока характеризуется некоторой дилатацией полости левого желудочка, дополнительным повышением диастолического давления в ней и снижением сердечного выброса. В дальнейшем возникает относительная митральная недостаточность, повышается давление в полости левого предсердия и лёгочных венах, что в итоге ведёт к развитию артериальной лёгочной гипертензии, перегрузке правого желудочка и правожелудочковой недостаточности. Возможности увеличения сердечного выброса в ответ на нагрузку при выраженном сужении устья аорты ограничены. Поэтому перераспределение крови в скелетные мышцы при физической нагрузке сопряжено при выраженном стенозе с недостаточным кровоснабжением миокарда и мозга, что проявляется стенокардией и синкопальными состояниями. Этому способствует учащение сердечных сокращений при нагрузке, сопровождающееся укорочением фазы изгнания, что препятствует увеличению и даже может привести к снижению фракции выброса.
Клинические проявления и течение. При небольшом сужении устья аорты, приобретённом в молодом возрасте, субъективные признаки порока отсутствуют иногда в течение десятилетий, причём больные нередко выполняют тяжёлую физическую работу и даже способны заниматься спортом. Умеренный и более выраженный аортальный стеноз относительно рано проявляется ощущением сердцебиений (в виде сильных ударов, а не высокой частоты), связанным с мощными сокращениями гипертрофированного левого желудочка сердца.
При развитии гемодинамических нарушений первые жалобы отражают формирующуюся централизацию кровообращения (смотри полный свод знаний: выше): появляется повышенная утомляемость, мышечная слабость, бледность кожи. По мере нарастания недостаточности компенсаторных процессов появляются характерные для аортального стеноза жалобы на боли в области сердца (стенокардия), головокружения и обмороки, а впоследствии и жалобы на одышку; все эти симптомы обычно провоцируются физической нагрузкой.
Стенокардия наблюдается у 40— 50% взрослых больных с ревматическим сужением устья аорты; частота её нарастает с увеличением возраста больных, длительности существования порока сердца и степени сужения устья аорты. В ряде случаев стенокардия быстро прогрессирует; ангинозные приступы, вначале возникающие только при нагрузке, появляются затем и в покое, иногда протекают в виде многочасового ангинозного статуса, рефрактерного к терапии нитратами.
Предобморочные состояния возникают иногда всего лишь при перемене положения тела. Физическая нагрузка у таких больных может провоцировать глубокий обморок (смотри полный свод знаний) с медленным восстановлением сознания.
Одышка в начале декомпенсации порока отмечается только при значительном физическом напряжении, затем толерантность к нагрузке снижается, и уже при малых напряжениях возможно развитие сердечной астмы с угрозой отёка лёгких.
Объективные признаки стеноза устья аорты — смотри таблицу.
Сочетание частых приступов стенокардии и синкопальных состояний и особенно появление сердечной астмы прогностически неблагоприятно, так как консервативное лечение в этой фазе течения порока мало успешно, а развитие сердечной недостаточности и других осложнений носит прогрессирующий характер.
По данным Хона (A. R. Hohn) с соавторами (1965), от 14 до 18% больных с тяжёлым аортальным стенозом погибает внезапно, причём иногда внезапная смерть служит первым проявлением болезни.
Осложнения. Среди возможных причин наблюдающихся случаев внезапной смерти предполагают фибрилляцию желудочков сердца (смотри полный свод знаний: Аритмии сердца). Вообще же нарушение ритма сердца у больных с аортальным стенозом наблюдается сравнительно нечасто и обычно протекает в форме желудочковой экстрасистолии. Глубокий обморок иногда завершается смертью больного.
К осложнениям, угрожающим жизни больных с выраженным аортальным стенозом, относятся также отёк лёгких (смотри полный свод знаний) и инфаркт миокарда (смотри полный свод знаний). Последний иногда развивается при ещё достаточно компенсированной общей гемодинамике, но в таких случаях его развитие обычно ведёт к возникновению и быстрому прогрессированию левожелудочковой сердечной недостаточности (смотри полный свод знаний).
Диагноз аортального стеноза при наличии типичной аускультативной симптоматики (грубый систолический шум с максимумом громкости над аортой, хорошо проводящийся на сонные артерии) и систолического дрожания несложен. Диагноз подтверждается типичной «аортальной» конфигурацией сердца по данным рентгенологическое исследования (рисунок 17) и особенно выявлением постстенотического расширения аорты (поскольку размеры левого желудочка могут значительно варьировать и даже приближаться к нормальным), а также признаками гипертрофии левого желудочка на ЭКГ, выявляемыми у большинства больных. В редких случаях, когда шум изгнания, характерный для аортального стеноза, выслушивается только на верхушке сердца, особое значение приобретают фонокардиографические признаки аортального стеноза (ромбовидный или веретенообразный характер шума, наличие парадоксального расщепления II тона) и данные каротидной сфигмографии (рисунок 18), а также отсутствие признаков митрального порока сердца, которые не выявляются и рентгенологически. Диагноз становится весьма трудным, если шум изгнания резко ослабевает вследствие развития недостаточности левого желудочка (уменьшается градиент давления между левым желудочком и аортой). Иногда диагноз облегчают данные эхокардиограммы (рисунок 19), но в ряде подобных случаев, если неизвестна предыстория заболевания, аортальный стеноз может остаться нераспознанным. Этиологического диагностика затруднена при отсутствии указаний на ревматизм в анамнезе. Ревматическая природа порока несомненна при комбинации аортального стеноза с пороком митрального клапана. Об атеросклеротической этиологии следует думать при первом выявлении незначительного изолированного аортального стеноза у пожилых больных.
 |
|  |
Рис. 19. | ||
Дифференциальный диагноз проводится прежде всего с врождённым аортальным стенозом, для которого характерно выявление признаков порока в раннем детском возрасте и нередкое сочетание с другими врождёнными аномалиями развития сердечно-сосудистой системы (незаращение артериального протока, коарктация аорты). Для проведения дифференциального диагноза с дефектом межжелудочковой перегородки (смотри полный свод знаний: Пороки сердца врождённые) иногда приходится прибегать к зондированию сердца, необходимому для окончательной верификации диагноза и определения показаний к оперативному вмешательству и его характера.
Нередко дифференциальный диагноз приходится проводить с идиопатическим гипертрофическим субаортальным стенозом (смотри полный свод знаний: Кардиомиопатии). Последняя патология отличается нетипичной локализацией шума, отсутствием систолического тона изгнания на верхушке сердца, кальцификации аортального клапана и постстенотической дилатации аорты. Для уточнения диагноза в таких случаях часто необходимо эхокардиографическое исследование (эхокардиограмма при субаортальном стенозе достаточно специфична), а в ряде случаев и зондирование сердца.
Отличить аортальный стеноз от сужения устья лёгочного ствола помогает локализация шума (при стенозе устья лёгочного ствола — во втором — третьем межреберьях слева от грудины), характерные для последнего порока постстенотическое расширение лёгочного ствола и признаки гипертрофии правого желудочка (по рентгенологическим и электрокардиографическим данным).
Сочетанный аортальный порок сердца
Сочетанный аортальный порок, то есть стеноз устья аорты и недостаточность аортального клапана, развивается почти во всех случаях в результате ревматизма, чаще у мужчин. В очень редких случаях сочетанный аортальный порок формируется при атеросклерозе и у больных с излеченным септическим эндокардитом аортального клапана, однако стеноз устья аорты у этих больных обычно выражен незначительно.
Патогенез гемодинамических нарушений складывается из патологический влияний на левый желудочек сердца нагрузок, свойственных как стенозу аорты, так и недостаточности аортального клапана. Регургитация крови из аорты в левый желудочек добавляет к вызванной стенозом перегрузке сопротивлением объёмную перегрузку, а отсутствие периода замкнутых клапанов препятствует необходимому при стенозе повышению градиента давления между левым желудочком и аортой. Гипертрофия левого желудочка, развивающаяся в этих условиях, не снижает существенно гиперфункции миокарда, поэтому относительно быстро возникает дилатация левого желудочка и декомпенсация порока. Снижение конечного диастолического давления в аорте увеличивает степень коронарной недостаточности гипертрофированного миокарда.
Клинические проявления и течение. Симптомы, свойственные изолированным аортальным порокам, наблюдаются и при сочетанном пороке, причём их выраженность отражает преобладание либо аортального стеноза, либо аортальной недостаточности (смотри полный свод знаний: таблицу). Течение сочетанного аортального порока отличается от изолированных более быстрым развитием левожелудочковой сердечной недостаточности (смотри полный свод знаний) и более частым развитием других осложнений. Различные клинические, формы коронарной недостаточности (стенокардия, инфаркт миокарда) возникают чаще и раньше и протекают тяжелее, чем при изолированном стенозе устья аорты или чистой аортальной недостаточности.
Диагноз сочетанного порока при наличии симптомов и стеноза устья аорты и аортальной недостаточности (смотри полный свод знаний: таблицу) несложен, но всегда трудно судить о том, что преобладает: аортальный стеноз или недостаточность. По данным исследования сердца выявить и оценить преобладание одной из форм порока не представляется возможным. Большее значение имеют периферические симптомы. Скачущий пульс, повышение пульсового давления, низкое диастолическое давление свидетельствуют о преобладании недостаточности; уменьшение амплитуды пульсации постстенотически расширенной аорты (по данным рентгенологическое исследования), некоторое снижение систолического давления при нормальном или слегка пониженном диастолическом давлении дают основание думать о преобладании стеноза. Данные измерения давления в камерах сердца и аорте далеко не всегда способствуют уточнению характера преобладающего поражения клапана, поскольку даже при наличии лишь умеренного (непреобладающего) стеноза выявляются высокий градиент давления между левым желудочком и аортой, значительное повышение диастолического давления в полости левого желудочка и тенденция к снижению минутного объёма; при наличии признаков сердечной недостаточности эти данные ещё менее специфичны. Большее диагностическое значение имеет контрастное рентгенологическое исследование левого желудочка и начального отдела аорты. Для оперативного лечения поражений аортального клапана вопрос о преобладании его стеноза или недостаточности не столь актуален, как при митральном пороке, так как в большинстве случаев сочетанного аортального порока при показаниях к оперативному вмешательству применяется протезирование поражённого клапана.
Недостаточность трикуспидального клапана (трикуспидальная недостаточность)
Наиболее частой причиной приобретённой трикуспидальной недостаточности является ревматизм (смотри полный свод знаний). Ревматические пороки трёхстворчатого клапана практически всегда формируются на фоне митральных, аортальных или митрально-аортальных пороков. Изолированная недостаточность трёхстворчатого клапана относится к числу очень редких пороков. Её причиной может быть септический эндокардит, особенно вызванный синегнойной палочкой (иногда ведущий к перфорации створки или обрыву сухожильной хорды), злокачественный карциноид тонкой кишки (смотри полный свод знаний: Карциноид), травмы клапана и разрыв папиллярных мышц при травмах и инфаркте миокарда правого желудочка (крайне редко). Органический порок встречается втрое реже, чем относительная трикуспидальная недостаточность, которая осложняет течение пороков митрального клапана, может быть результатом лёгочной гипертензии другой природы (хронический лёгочное сердце, первичная лёгочная гипертензия) или поражений миокарда правого желудочка (миокардит, инфаркт, кардиосклероз).
Патогенез гемодинамических нарушений, связанный с наличием регургитации крови из правого желудочка сердца в правое предсердие во время систолы, и соответствующие компенсаторные механизмы во многом сходны с гемодинамическими изменениями и компенсаторными механизмами при митральной недостаточности. Степень регургитации определяется площадью отверстия, через которое кровь забрасывается из желудочка в предсердие во время систолы. Из-за ограниченных компенсаторных возможностей тонкостенного правого предсердия рано возникает системная венозная гипертензия и развёрнутая картина правожелудочковой недостаточности. Регургитация крови в правое предсердие во время систолы служит причиной появления типичного для трикуспидальной недостаточности голосистолического шума. На кривой давления в правом предсердии появляется высокая систолическая волна, что находит отражение и в динамике давления в яремных венах. При значительной степени трикуспидальной недостаточности кривая давления в правом предсердии приобретает значительное сходство с кривой давления в правом желудочке (вентрикулизация). Высота волны и громкость систолического шума увеличиваются во время вдоха. Диастолическое давление в правом желудочке и среднее давление в правом предсердии, а также системное венозное давление при трикуспидальной недостаточности повышены. При тяжёлой трикуспидальной недостаточности из-за резкого расширения полостей правых предсердия и желудочка при меньшем расширении клапанного кольца возможно рождение турбулентных потоков при перемещении крови из предсердия в желудочек, что проявляется нежным диастолическим шумом (так называемый относительный трикуспидальный стеноз).
Клинические проявления и течение. До развития декомпенсации порока возможны жалобы на ощущение сердцебиения при физическом напряжении, иногда при изменениях положения тела, в том числе при переходе в горизонтальное положение. С началом декомпенсации появляются утомляемость, слабость, снижается дневной диурез (признаки «централизации» кровообращения в связи со снижением объёма кровообращения). Затем появляются жалобы, отражающие развитие застойной правожелудочковой недостаточности: гипостатические отеки, нарастающие к вечеру (обычно на стопах, голенях), чувство тяжести в эпигастрии (из-за увеличения печени), увеличение живота (развитие асцита).
Объективные признаки трикуспидальной недостаточности — смотри таблицу.
Течение трикуспидальной недостаточности характеризуется довольно быстрым развитием декомпенсации порока, усугубление которой сопровождается и нарастанием рефрактерности к лечению (добиться полного устранения проявлений выраженной правожелудочковой недостаточности обычно не удаётся). Особенно тяжело протекает относительная трикуспидальная недостаточность, возникшая в результате декомпенсации других Пороки сердца приобретённые (чаще всего митрального порока). Её появление знаменует собой начало тяжёлой необратимой недостаточности сердца. Тем не менее в период возникновения относительной трикуспидальной недостаточности у больного с митральным пороком возможно улучшение самочувствия в связи с уменьшением одышки, ортопноэ и редким появлением в этот период приступов сердечной астмы или отёка лёгких («разгрузка» малого круга кровообращения).
Диагноз трикуспидальной недостаточности до развития выраженной декомпенсации порока предполагают при обнаружении голосистолического шума в типичных зонах аускультации трёхстворчатого клапана с усилением этого шума во время вдоха. Наличие трикуспидальной недостаточности подтверждается выявлением систолического венного пульса (рисунок 20) и рентгенологическое признаков увеличения правого предсердия.
Дифференциальный диагноз в основном проводится с относительной недостаточностью трёхстворчатого клапана, что во многих случаях весьма трудно. Об органическом характере изолированной трикуспидальной недостаточности позволяет думать диспропорция между гемодинамическими проявлениями недостаточности трёхстворчатого клапана и уровнем давления в лёгочной артерии или лёгочного сосудистого сопротивления. Длительное пребывание больного на постельном режиме и энергичное медикаментозное лечение могут на какое-то время уменьшить аускультативную симптоматику относительной трикуспидальной недостаточности, тогда как симптоматика органического порока, напротив, усиливается.
Стеноз правого атриовентрикулярного отверстия (трикуспидальный стеноз)
Приобретённый трикуспидальный стеноз всегда имеет ревматическую природу и за редчайшими исключениями представляет собой один из компонентов сложно-комбинированных многоклапанных ревматических пороков сердца.
Патогенез гемодинамических нарушений. Ведущую роль играет высокий диастолический градиент давления между правым предсердием и правым желудочком, достигающий 3—13 миллиметров ртутного столба, за счёт повышения давления в правом предсердии. Градиент достигает максимума в конце систолы желудочков и постепенно снижается в период диастолы; при отсутствии мерцательной аритмии (обычной у таких больных) возможно пресистолическое повышение градиента в период сокращения предсердий. На величину градиента давления влияют те же факторы, что и при митральном стенозе, и, кроме того, фазы дыхания: градиент нарастает во время вдоха и уменьшается во время выдоха. Эта особенность отражает колебания венозного возврата, связанные с фазами дыхания. В связи с высоким предсердно-желудочковым градиентом давления линейная скорость кровотока во время диастолы через суженное правое атриовентрикулярное отверстие возрастает, что порождает турбулентные течения крови, являющиеся причиной формирования диастолического шума с пресистолическим усилением, если сохранен синусовый ритм. При мерцательной аритмии скорость перемещения крови в желудочек к концу диастолы снижается и образуется протодиастолический затухающий шум. Резкий прогиб ригидных створок воронкообразно суженного клапана в момент систолы правого желудочка сердца может быть причиной возникновения щелчка, или «тона открытия» трёхстворчатого клапана. Поскольку возможность развития компенсаторной гипертрофии в тонкостенном миокарде правого предсердия ограничена, оно рано дилатируется; в венах большого круга кровообращения возникает гипертензия и застой крови.
Клинические проявления и течение. В период компенсации порока больные могут не предъявлять никаких жалоб. Однако течение трикуспидального стеноза характеризуется ранним возникновением мерцательной аритмии с последующим быстрым прогрессированием правожелудочковой сердечной недостаточности. В этот период жалобы больных аналогичны описанным при трикуспидальной недостаточности (смотри полный свод знаний: выше).
Объективные признаки трикуспидального стеноза — смотри таблицу.
Осложнения. Кроме мерцательной аритмии и недостаточности кровообращения, обычно осложняющих течение порока в стадии его декомпенсации, нередким осложнением является флеботромбоз (смотри полный свод знаний), развивающийся на фоне застойной недостаточности кровообращения, и тромбоэмболии в лёгочные артерии.
Диагноз трикуспидального стеноза предполагается главным образом при наличии диастолического шума (протодиастолического при мерцательной аритмии и преимущественно пресистолического при синусовом ритме), выслушиваемого в проекции трикуспидального клапана (по левому краю грудины в нижней её части или над мечевидным отростком) и усиливающегося на вдохе. Такое же усиление на вдохе приобретает и «тон открытия» трикуспидального клапана, если он выслушивается. Эти данные объективизируются с помощью ФКГ (рисунок 21). При синусовом ритме диагноз подтверждается наличием резко увеличенной волны сокращения предсердия на сфигмограмме яремной вены. При мерцательной аритмии подтверждение диагноза может быть весьма трудным даже при наличии данных инвазивного исследования (смотри полный свод знаний: таблицу).
Дифференциальный диагноз проводится прежде всего с митральным стенозом, дающим сходную аускультативную картину. Однако диастолический шум митрального стеноза никогда не проводится в область аускультации трикуспидального клапана и ни он, ни «тон открытия» митрального клапана не имеют столь выраженной зависимости от фаз дыхания, как соответствующие шум и тон при трикуспидальном стенозе.
К сужению правого предсердножелудочкового отверстия, сопровождающемуся симптоматикой трикуспидального стеноза, могут вести опухоли правого предсердия (миксома, саркома, метастазы опухолей других органов), тромбы правого предсердия (реже правого желудочка) и полипоидно-тромботические разрастания на клапанах при бактериальном эндокардите. Дифференциальный диагноз в этих случаях невозможен без широкого использования дополнительных методов исследования (эхокардиографии, зондирования сердца с контрастированием его полостей).
Сочетанный трикуспидальный порок сердца
Сочетание стеноза правого атриовентрикулярного отверстия с недостаточностью трикуспидального клапана встречается чаще, чем изолированный трикуспидальный стеноз или чистая органическая трикуспидальная недостаточность; как правило, одновременно выявляются поражения других клапанов (митрального, аортального). Причиной порока, за редчайшими исключениями, является ревматизм; казуистическими причинами могут служить образование межклапанных сращений у больных с излеченным бактериальным эндокардитом и поражение трёхстворчатого клапана при саркоидозе. В этих случаях поражения других клапанов сердца обычно отсутствуют, а стеноз не достигает степени, при к-рои возникают значимые изменения гемодинамики.
Патогенез гемодинамических нарушений представлен сочетанием ведущих патогенетических механизмов, свойственных изолированным трикуспидальным порокам. При сочетании достаточно выраженного стеноза со значительной недостаточностью гемодинамические нарушения, присущие как стенозу, так и недостаточности, взаимно отягощаются и застойная правожелудочковая и правопредсердная недостаточность возникает особенно рано и носит крайне рефрактерный характер.
Диагноз базируется в основном на сочетании аускультативных и других признаков трикуспидального стеноза и трикуспидальной недостаточности (смотри полный свод знаний: таблицу). Если симптоматика трикуспидальной недостаточности появилась раньше, чем симптоматика стеноза, следует полагать, что последний имеет функциональный характер. Изолированное поражение трёхстворчатого клапана требует уточнения диагностики поиском симптомов саркоидоза (смотри полный свод знаний), установлением в анамнезе излеченного бактериального эндокардита.
Недостаточность клапана лёгочного ствола
При ревматизме и атеросклерозе органическая недостаточность всегда сочетается с сужением устья лёгочного ствола. Описаны лишь единичные случаи изолированной недостаточности клапана лёгочного ствола, связанной прежде всего с бактериальным эндокардитом и в редких случаях — с сифилисом. Гораздо чаще наблюдается относительная недостаточность клапана вследствие значительной дилатации лёгочного ствола и правого желудочка при заболеваниях, протекающих с лёгочной гипертензией (первичная лёгочная гипертензия, хронический лёгочное сердце, ревматические пороки митрального клапана, синдром Эйзенменгера, незаращение артериального протока и некоторые другие врождённые пороки сердца).
Патогенез гемодинамических нарушений. Основным гемодинамическим выражением порока является регургитация крови из лёгочного ствола в правый желудочек при его диастолическом расслаблении. Максимальная регургитация происходит в самом начале диастолы, когда перепад давления между полостями лёгочного ствола и правого желудочка наибольший. В этот период регургитационный поток через дефект клапана имеет линейную скорость, достаточную для формирования турбулентных течений, что проявляется, как и при аортальной недостаточности, протодиастолическим шумом. При дилатации правого желудочка и значительном надклапанном расширении лёгочного ствола могут возникать турбулентные потоки в зоне клапана и в систолическую фазу, создавая систолический шум, при наличии которого говорят о так называемый относительном стенозе лёгочного ствола (чаще, однако, систолический шум обусловлен истинным сужением лёгочного ствола, то есть свидетельствует о сочетанном клапанном пороке).
Масса крови, регургитируемой в правый желудочек, создаёт для него дополнительную нагрузку объёмом, компенсируемую гиперфункцией желудочка, ведущей к его гипертрофии. Гемодинамические сдвиги при изолированной органической недостаточности клапана лёгочного ствола носят менее тяжёлый характер и лучше компенсируются, чем в большинстве случаев относительной недостаточности, поскольку в норме давление в лёгочном стволе невелико (менее 20 миллиметров рт. ст.), в связи с чем незначителен и градиент давления между лёгочным стволом и правым желудочком, а соответственно невелик и объем регургитирующей крови. Напротив, при высокой лёгочной гипертензии, ведущей к формированию относительной недостаточности, градиент давления и объем регургитирующей крови могут быть очень значительны. При этом правый желудочек испытывает большую, чем при изолированном пороке, нагрузку объёмом в дополнение к уже имевшейся ранее нагрузке избыточным сопротивлением. Гиперфункция в этих условиях не компенсируется даже выраженной гипертрофией правого желудочка, он дилатируется, и развивается застойная недостаточность кровообращения.
Клинические проявления и течение. При изолированной органической недостаточности клапана лёгочного ствола жалобы больных и признаки нарушений общей гемодинамики наблюдаются лишь при значительной степени утраты клапанной функции. Возможны жалобы на ощущение сердцебиений, утомляемость, одышку при физическом напряжении, приступы сухого кашля. В стадии недостаточности правого желудочка сердца появляется сонливость, нарастают отеки, которые могут быть установлены при осмотре больного наряду с наличием акроцианоза (смотри полный свод знаний).
Сердечный толчок усилен; перкуторные границы относительной тупости сердца существенно не изменены, а в стадии декомпенсации порока расширены вправо; выявляется расширение границ перкуторного притупления в зоне сосудистого пучка.
Наиболее постоянным и информативным симптомом недостаточности клапана лёгочного ствола является диастолический шум, который лучше всего выслушивается во втором — третьем межреберье слева от грудины; он начинается сразу после II тона сердца, носит дующий, убывающий характер и обычно затухает, не достигнув середины диастолы. Характеристика этого шума на фонокардиограмме такая же, как для шума при аортальной недостаточности.
Рентгенологически выявляются гипертрофия правого желудочка, выбухание и удлинение дуги лёгочного ствола с энергичной его пульсацией, симптом «пляски» лёгочных корней; тень дуги аорты сужена.
ЭКГ — без отклонений от нормы и лишь при выраженном пороке наблюдаются её изменения, характерные для гипертрофии правого желудочка.
Эхокардиографически в некоторых случаях выявляется диастолическое трепетание створок трикуспидального клапана, вызываемое волной регургитации.
Течение порока с незначительной недостаточностью клапанной функции обычно не нарушает трудоспособности больных, поэтому диагностика порока основывается лишь на объективных данных. При значительном пороке его течение резко ухудшается с момента декомпенсации; сердечная недостаточность сопровождается интенсивным цианозом (смотри полный свод знаний), гепатомегалией (смотри полный свод знаний: Печень), отёками (смотри полный свод знаний: Отёк) и рефрактерна к консервативной терапии.
Осложнения возможны ещё до развития выраженной декомпенсации в виде хронический бронхита (при частой склонности к острым бронхитам) и бактериального эндокардита. При развитии сердечной недостаточности возможны флеботромбозы (смотри полный свод знаний) и тромбоэмболии в лёгочные артерии.
Диагноз представляет трудности прежде всего из-за редкости порока. Он предполагается в основном при выслушивании протодиастолического шума в проекции лёгочного ствола, когда не обнаруживаются гипертрофия левого желудочка и периферические симптомы аортальной недостаточности. Подтверждение диагноза проводится с использованием дополнительных методов обследования, включая зондирование сердца. При наличии недостаточности клапана лёгочного ствола катетеризация последнего выявляет высокоамплитудную кривую давления в лёгочном стволе (за счёт низкого диастолического и несколько повышенного систолического давления); диастолическое давление в лёгочном стволе может уравняться с давлением в правом желудочке в середине или ближе к концу диастолы; при этом кривая давления в лёгочном стволе становится сходной с кривой давления в правом желудочке. Данные контрастной ангиографии лёгочного ствола не всегда убедительны, так как возможна регургитация через неизменённый клапан в связи с отклонением его заслонок катетером.
Дифференциальный диагноз при выслушивании протодиастолического шума проводится прежде всего с аортальной недостаточностью на основании исследования периферических симптомов и гипертрофии левого желудочка, характерных для последнего порока. При установлении недостаточности клапана лёгочного ствола проводится дифференциация между органическим пороком и относительной недостаточностью. Обычно диастолический шум при относительной недостаточности клапана (шум Грэма Стилла) сочетается с акцентом II тона над лёгочным стволом, рентгенологическое признаками артериальной лёгочной гипертензии и при этом обнаруживаются симптомы заболеваний, обусловивших лёгочную гипертензию (пороки митрального клапана, хронический заболевания лёгких и другие). На фонокардиограмме шум Грэма Стилла начинается не сразу, как при пороке, а через 50—100 микросекунд после лёгочного компонента II тона.
В случаях, когда аускультативная картина органической недостаточности клапана лёгочного ствола дополняется систолическим шумом, возникает необходимость дифференциального диагноза с незаращением артериального протока, распознавание которого основывается на свойственных ему клинические, проявлениях (смотри полный свод знаний: Артериальный проток) и данных инвазивных методов исследования.
Стеноз устья лёгочного ствола
Приобретённый стеноз устья лёгочного ствола, в отличие от врождённого (смотри полный свод знаний: Пороки сердца врождённые), очень редко бывает изолированным. Обычно он встречается при ревматизме в сочетании с недостаточностью клапана лёгочного ствола и в комбинации с поражением других клапанов сердца. Редчайшее исключение представляет изолированный стеноз устья лёгочного ствола при карциноиде (смотри полный свод знаний).
Патогенез гемодинамических нарушений. Основное гемодинамическое проявление стеноза устья лёгочного ствола — наличие высокого градиента давления между правым желудочком и лёгочным стволом (более 15 миллиметров ртутного столба.) за счёт гиперфункции правого желудочка вследствие нагрузки сопротивлением (давление в лёгочном стволе при изолированном стенозе остаётся нормальным или несколько понижено). Величина градиента зависит от степени сужения устья лёгочного ствола, величины лёгочного кровотока и частоты сердечных сокращений. Повышение давления в правом желудочке ведёт к развитию его компенсаторной концентрической гипертрофии, обычно без значительного увеличения полости. Мощная гипертрофия может стать причиной развития дополнительной обструкции на пути оттока из правого желудочка — инфундибулярного стеноза. Поскольку в период систолы кровоток через суженное отверстие происходит с большой скоростью, возникают турбулентные движения крови, являющиеся причиной появления систолического шума изгнания, а также увеличения бокового давления над клапаном и развития постстенотической дилатации лёгочного ствола.
Клинические проявления и течение. Жалобы больных неспецифичны (одышка, быстрая утомляемость, иногда стенокардия); нередко первые жалобы связаны с развитием правожелудочковой недостаточности. Основной аускультативный признак стеноза устья лёгочного ствола — грубый систолический шум во втором — третьем межреберьях слева от грудины. Обычно интенсивность шума пропорциональна степени стеноза. При выраженном стенозе в области максимальной громкости шума может определяться систолическое дрожание. II тон в той же области нередко раздвоен (в связи с удлинением фазы изгнания крови из правого желудочка), причём промежуток между компонентами II тона увеличивается на высоте вдоха.
При наличии синусового ритма нередко выявляется пресистолическая венозная пульсация яремных вен и печени, возникающая в результате мощной систолы правого предсердия, необходимой для нагнетания крови в ограниченно растяжимый правый желудочек.
Рентгенологически в случаях выраженного стеноза обычно обнаруживается увеличение правого желудочка, иногда значительное; при умеренном стенозе этот признак выявляется не всегда. Характерно выбухание конуса лёгочного ствола, связанное с постстенотической дилатацией. Сосудистый рисунок лёгких может быть обеднён.
Удовлетворительно отражают степень стеноза данные ЭКГ. При умеренном стенозе устья лёгочного ствола ЭКГ может оставаться неизменённой, хотя у большинства больных регистрируется высокий зубец R в отведении V1 или неполная блокада правой ножки пучка Гиса (смотри полный свод знаний: Блокада сердца, Проводящая система сердца). При тяжёлом стенозе практически всегда отмечаются признаки гипертрофии правого желудочка (обратные соотношения амплитуд зубцов R и S в правых грудных отведениях, глубокие зубцы S в левых грудных отведениях).
Фонокардиография (смотри полный свод знаний) подтверждает наличие высокоамплитудного систолического шума овальной, ромбовидной или веретенообразной формы, расщепление II тона, достигающее максимальной выраженности на высоте вдоха и уменьшение амплитуды лёгочного компонента II тона или его исчезновение.
Течение порока зависит от степени стеноза: оно становится тяжёлым лишь при выраженном стенозе, ведущем к сердечной недостаточности.
Осложнения, кроме недостаточности кровообращения, характеризуются развитием хронический бронхита и возможным бактериальным эндокардитом.
Диагноз устанавливают по типичной аускультативной картине, исключая сдавление лёгочного ствола опухолью или аневризматически расширенной аортой.
Дифференциальный диагноз необходим с более частым врождённым стенозом устья лёгочного ствола (смотри полный свод знаний: Пороки сердца врождённые).
Комбинированные пороки сердца
Комбинированное поражение нескольких клапанов сердца часто наблюдается при Пороки сердца приобретённые, особенно при ревматической их этиологии. По разным статистическим данным, их частота составляет от 30 до 50% всех случаев Пороки сердца приобретённые Наиболее часто выявляется комбинация поражения клапанов левого сердца — митрального и аортального (митрально-аортальный порок); следующей по частоте является комбинация митрального и (или) аортального порока с трикуспидальным (митрально-трикуспидальный порок, митрально-аортально-трикуспидальный порок); другие комбинации клапанного поражения встречаются значительно реже.
Митрально-аортальные пороки сердца ревматической этиологии проявляются преимущественно в форме двойного стеноза или стеноза одного из клапанов и недостаточности другого, при бактериальном эндокардите и атеросклерозе (крайне редко) — в форме недостаточности этих клапанов. Возможны также варианты, когда сочетанный порок одного из этих клапанов дополняется стенозом или недостаточностью другого или формируются два сочетанных порока. По существу, диагностика комбинации аортального и митрального органических пороков означает и диагноз их ревматической этиологии.
Комбинированные пороки взаимно влияют на клинические, проявления и течение каждого из них. Так, при комбинации митральной недостаточности с аортальным стенозом на величину желудочково-предсердной регургитации существенно влияет сопротивление кровотоку на уровне аортального клапана. Чем выражен неё аортальный стеноз, тем больше регургитация крови в предсердие и перегрузка последнего и тем меньше эффективный ударный объем сердца. Поэтому комбинация митральной недостаточности с выраженным аортальным стенозом протекает особенно тяжело и быстро ведёт к развитию сердечной недостаточности. Д
При комбинации аортального и митрального стенозов до наступления декомпенсации аортального порока ведущее клинические, значение часто имеет митральный стеноз. При нагрузках больные отмечают одышку, сердцебиение, иногда приступы сердечной астмы, кровохарканье. Формируются признаки лёгочной гипертензии, гипертрофия правого желудочка сердца. Если в это время ещё нет дилатации левого желудочка, а его гипертрофия и систолический шум находят ошибочное объяснение, то диагноз аортального стеноза может быть не установлен. Не всегда устанавливается при выраженном митральном стенозе также аортальная недостаточность, периферические симптомы которой из-за снижения сердечного выброса смягчаются, а ведущий аускультативный признак — диастолический шум — может расцениваться как шум Грэма Стилла (шум относительной недостаточности клапана лёгочного ствола). При отчётливом аортальном пороке не меньшие трудности иногда вызывает подтверждение митрального стеноза. На первый план выступают жалобы на головокружения, обмороки, приступы стенокардии, напряжения. Аускультативные признаки митрального порока на фоне аортальной недостаточности маскируются или исчезают, а сохраняющиеся с трудом дифференцируются с вторичными симптомами, которые бывают обусловлены самим аортальным пороком, — шумом Флинта (шумом функционального митрального стеноза, образуемого в диастолу передней створкой митрального клапана, приподнимаемой потоком крови, регургитируемой из аорты) и другими признаками «митрализации» аортального порока.
Прогноз при комбинации митрального и аортального стенозов благоприятнее, чем при декомпенсации изолированного аортального порока, ведущей к его «митрализации». При таком комбинированном пороке митральная комиссуротомия не производится, так как она может привести к острой декомпенсации кровообращения.
Митрально-трикуспидальные и митрально-аортально-трикуспидальные пороки сердца. Формирование наряду с митральным или митрально-аортальным пороком сердца при ревматизме одновременно и стеноза правого атриовентрикулярного отверстия или органической недостаточности трикуспидального клапана происходит нередко (поражение трикуспидального клапана отмечается примерно в половине всех случаев комбинированных Пороки сердца приобретённые). Однако уверенная их диагностика возможна лишь при отсутствии декомпенсации клапанных пороков левого сердца. В таком случае диагноз устанавливается по наличию типичных симптомов трикуспидального стеноза (смотри полный свод знаний: выше) или трикуспидальной недостаточности (смотри полный свод знаний: выше), а также комбинации их рентгенологическое проявлений (рисунок 22). Необходимо учитывать, что наличие трикуспидального стеноза в сочетании с митральным пороком сердца значительно уменьшает опасность развития таких осложнений митрального порока, как сердечная астма (смотри полный свод знаний), кровохарканье (смотри полный свод знаний) и отёк лёгких (смотри полный свод знаний), что связано с ограничением возможности повышения сердечного выброса из-за наличия препятствия кровотоку на уровне трёхстворчатого клапана. При наличии органической трикуспидальной недостаточности её комбинация с митральными пороками приводит к быстрой и выраженной правожелудочковой недостаточности из-за свойственной митральным порокам лёгочной гипертензии, дополняющей нагрузку сопротивлением на правый желудочек, уже имеющий дополнительную нагрузку объёмом.
Некоторые трудности представляет диагностика комбинации одновременно трёх стенозов — аортального, митрального и трикуспидального (так называемый митрально-аортально-трикуспидальный стеноз), которая наблюдалась, по данным Г. И. Цукермана (1969), у 7—8% больных, оперированных по поводу ревматических пороков. Симптомы этих пороков при их комбинации частично интерферируют между собой (например, аускультативная картина стенозов атриовентрикулярных отверстий), частично нивелируют проявления каждого из сопутствующих пороков (например, гипертрофия и левого, и правого желудочков сердца). Завершающим этапом диагностики в таких случаях является использование инвазивных методов исследования сердца, так как больным показана одномоментная комиссуротомия на всех трёх клапанах, значительно улучшающая прогноз.
Наибольшие трудности представляет диагноз органической недостаточности трикуспидального клапана при наличии декомпенсированных митральных или митрально-аортальных пороков, так как их декомпенсация часто сопровождается относительной трикуспидальной недостаточностью. В ряде таких случаев дифференциальную диагностику осуществить не удаётся даже при использовании инвазивных методов исследования. В то же время правильному диагнозу может способствовать клинические, наблюдение в динамике при энергичном лечении декомпенсации кровообращения. Если такое лечение приносит успех, то аускультативные и другие признаки относительной трикуспидальной недостаточности обычно ослабевают, а при органической трикуспидальной недостаточности аускультативные признаки усиливаются.
Другие комбинированные пороки сердца относятся к весьма редким. Среди очень редких вариантов наблюдается и комбинация Пороки сердца приобретённые с врождёнными пороками, например, формирование приобретённого митрального стеноза ревматической этиологии у больного о врождённым незаращением овального отверстия — синдром Лютамбаше (смотри полный свод знаний: Пороки сердца врождённые). При этой комбинации наличие митрального стеноза способствует устойчивому направлению межпредсердного шунтового сброса слева направо.
Консервативное лечение больных с приобретёнными пороками сердца
К радикальным методам лечения больных с Пороки сердца приобретённые относится только оперативная коррекция сформировавшегося порока сердца (смотри полный свод знаний: ниже раздел «Хирургическое лечение приобретённых пороков сердца»). В то же время консервативное лечение осуществляется практически у всех больных с Пороки сердца приобретённые, как подлежащих оперативному лечению (до и после операции), так и не имеющих показаний к нему.
Объем средств и методов консервативной терапии определяется состоянием компенсации порока и общей гемодинамики, а также имеющимися или угрожающими осложнениями. С момента первичной диагностики Пороки сердца приобретённые больные подлежат диспансерному наблюдению в кардиоревматологический кабинетах поликлиник, где определяют объем необходимого лечения, контролируют его эффективность и осуществляют динамическое наблюдение за состоянием показателей компенсации кровообращения (смотри полный свод знаний: Диспансеризация). Всем больным санируют хронический очаги инфекции и проводят курсовую (по показаниям) или сезонную профилактику обострений ревматизма (смотри полный свод знаний). В редких случаях неревматической этиологии Пороки сердца приобретённые проводится лечение и профилактика обострений соответствующего основного заболевания.
При Пороки сердца приобретённые в стадии полной компенсации больным рекомендуют определённый режим физических нагрузок (в зависимости от вида порока) и соответствующее трудоустройство. Основное место в терапии больных с компенсированными Пороки сердца приобретённые занимает лечебный физкультура (смотри полный свод знаний: ниже). При Пороки сердца приобретённые, сопровождающихся выраженной гипертрофией желудочков сердца, не исключена целесообразность назначения сердечных гликозидов (смотри полный свод знаний) ещё до появления декомпенсации с целью отдаления сроков её наступления (так называемый профилактическая дигитализация).
При декомпенсированных Пороки сердца приобретённые физическую активность больных ограничивают, назначая по необходимости домашний или даже постельный режим. В зависимости от вида порока избираются средства борьбы с декомпенсацией кровообращения. При декомпенсации митрального стеноза, проявляющейся «митральной астмой», отёком лёгких, а также при декомпенсации трикуспидального стеноза проводится симптоматическая терапия, включающая применение диуретических средств (смотри полный свод знаний: Мочегонные средства), оксигенотерапии (смотри полный свод знаний: Кислородная терапия), иногда кровопускание (смотри полный свод знаний). В этих случаях сердечные гликозиды не назначают, так как отсутствуют показания к их применению. Если же в основе декомпенсации лежит недостаточность миокарда желудочков — левого (при аортальных пороках, митральной недостаточности) или правого (при органической или относительной трикуспидальной недостаточности), развивающаяся вследствие дистрофии миокарда от гиперфункции, то применение сердечных гликозидов часто становится ведущим в лечении декомпенсации. Их назначают в этих случаях пожизненно в контролируемой индивидуальной дозе (отменяются в случае активного кардита или при нарушениях электролитного баланса до их ликвидации) наряду с другими симптоматическими средствами и средствами, улучшающими метаболизм миокарда (смотри полный свод знаний: Сердечная недостаточность).
При возникновении осложнений осуществляется их лечение, а в последующем, по возможности, назначаются средства их профилактики. Наиболее частое осложнение митральных пороков — мерцательную аритмию (смотри полный свод знаний) лишь в части случаев удаётся надолго ликвидировать с помощью дефибрилляции (смотри полный свод знаний) и (или) антиаритмических средств (смотри полный свод знаний: Противо аритмические средства). В случае частых рецидивов мерцательной аритмии целесообразно перевести её в постоянную форму с последующим достижением необходимого темпа сердечных сокращений с помощью сердечных гликозидов или других средств. Удержание постоянной мерцательной аритмии предотвращает развитие так называемый нормализационной тромбоэмболии (т. е. связанной с перемещением внутрипредсердного тромба в желудочек вследствие возобновления сокращений предсердий при восстановлении синусового ритма после мерцательной аритмии), ноне снижает вероятность тромбоэмболий вообще. В случае возникновения тромбоэмболий (смотри полный свод знаний) или при реальной их угрозе (например, при необходимости восстановления синусового ритма у больных с мерцательной аритмией, при достижении очень высокого диуреза с помощью мочегонных средств у больных со склонностью к флеботромбозам и так далее) назначают антикоагулянты (смотри полный свод знаний). У больных с митральным стенозом необходимость в специальной терапии может возникнуть при обильном кровохарканье (смотри полный свод знаний) и нередко наблюдающихся у них рецидивирующих бронхитах (смотри полный свод знаний).
Во всех случаях установления Пороки сердца приобретённые характер и степень порока должны быть оценены с целью определения показаний к оперативному лечению с учётом состояния компенсации кровообращения.
Лечебная физкультура. Применение ЛФК в комплексном лечении больных с Пороки сердца приобретённые обосновано тем, что с помощью физических упражнений можно создавать условия гемодинамики, облегчающие работу сердца и повышающие эффективность компенсаторных процессов. Кроме того, систематическое применение дозированных физических упражнений улучшает трофические процессы в миокарде и способствует его адаптации к новым условиям кровообращения.
При пороках сердца, ведущих к снижению объёма кровообращения, снижению периферического капиллярного кровотока, венозному застою, ряд упражнений ЛФК способствует росту сердечного выброса и улучшению кровоснабжения тканей. Ритмические сокращения и расслабления скелетных мышц за счёт периодического сдавливания венозных сосудов способствуют продвижению венозной крови к сердцу. Улучшают венозный возврат и дыхательные упражнения как в связи с колебаниями внутригрудного давления, так и за счёт активных движений диафрагмы в сторону брюшной полости, что способствует вытеснению венозной крови из печени, уменьшая застой в ней, и из вен других органов брюшной полости. Раскрытие резервных капилляров при физических упражнениях способствует снижению патологически повышенного сопротивления кровотоку в тканях, что улучшает периферический кровоток и при ряде пороков (например, при аортальном стенозе) облегчает работу сердца.
ЛФК при Пороки сердца приобретённые показана при компенсированном состоянии гемодинамики и при недостаточности кровообращения I и II степени. Противопоказаниями являются нарастание недостаточности кровообращения, обострение кардита, присоединившиеся пневмонии, плевриты и другие осложнения.
При компенсированных Пороки сердца приобретённые используют все основные формы и средства ЛФК (смотри полный свод знаний: Лечебная физкультура как метод лечения), включая лечебный гимнастику, прогулки, терренкур от 1 до 3 км (смотри полный свод знаний: Терренкур), дозированные занятия лыжами, бадминтоном, плавание (кратковременно) и другие
При недостаточности кровообращения I и II степени применение ЛФК у больных с Пороки сердца приобретённые ограничено главным образом лечебный гимнастикой. В зависимости от вида порока сердца, от преимущественной локализации и степени гемодинамических нарушений, а также от предшествовавшей физической активности больных ЛФК может начинаться с упражнений, выполняемых только лёжа, либо с дополнением их упражнениями, выполняемыми сидя, либо, наконец, могут быть разрешены и упражнения, выполняемые в положении стоя.
У больных с выраженными проявлениями недостаточности кровообращения II степени ЛФК всегда начинают с упражнений, выполняемых в положении больного лёжа на спине в кровати с приподнятым головным концом, а к упражнениям в положении сидя и стоя переходят постепенно — по мере улучшения состояния больных и уменьшения явлений недостаточности, тщательно следя за адекватностью реакции больных на нагрузку. В первые дни применяют упражнения для дистальных отделов конечностей, чередуя их с неглубокими дыхательными движениями. В процессе тренировки при хорошей переносимости больным лечебный гимнастики физическая нагрузка постепенно увеличивается, в упражнения включаются все мышцы конечностей и корпуса, темп возрастает.
При хирургическом лечении пороков сердца лечебный гимнастика применяется в пред и послеоперационном периодах; в предоперационном периоде (смотри полный свод знаний) — с целью воздействия на вспомогательные факторы кровообращения, улучшения функции дыхания, а также для ознакомления больного с теми упражнениями, которые будут использованы в раннем послеоперационном периоде (смотри полный свод знаний), — обучение щадящему откашливанию, правильному дыханию и другие Методика и дозировка определяются состоянием больного и степенью недостаточности кровообращения. Чаще всего они такие же, как при недостаточности кровообращения II степени. В раннем послеоперационном периоде к лечебный гимнастике приступают в первые сутки после операции, когда используются многократно в течение дня дыхательные упражнения и упражнения для дистальных отделов конечностей, а также с осторожностью специальные упражнения для левого плечевого сустава. Противопоказаниями к проведению послеоперационной гимнастики являются тяжёлое общее состояние и вторичное кровотечение. На 4—5-й день больным разрешается садиться, на 7-й день вставать с постели. В позднем послеоперационном периоде (на 10—12-й день после операции) при вполне удовлетворительном состоянии больных упражнения выполняются в положении стоя, нагрузка постепенно увеличивается; применяют общеукрепляющие и корригирующие упражнения с целью восстановления нормальной осанки и полного объёма движений в левом плечевом суставе. Общей задачей лечебный гимнастики в послеоперационном периоде является восстановление адекватности реакций сердечнососудистой и дыхательной систем к возрастающим физическим нагрузкам. Под влиянием лечебный гимнастики предупреждается возникновение послеоперационных осложнений (пневмонии, ателектаза), облегчается процесс компенсации сердечно-сосудистой и дыхательной систем, полностью восстанавливаются движения в плечевом суставе.
Профилактика и реабилитация
Профилактика. К первичной профилактике Пороки сердца приобретённые относятся мероприятия, направленные на предупреждение болезней, которые могут вести к формированию пороков сердца, и в первую очередь ревматизма (смотри полный свод знаний). Большое значение имеет рациональное систематическое закаливание организма (смотри полный свод знаний: Закаливание) начиная с раннего возраста, проводимое с учётом индивидуальных особенностей ребёнка, привитие прочных навыков индивидуальной гигиены и тщательная санация очагов инфекции — лечение кариозных зубов (смотри полный свод знаний: Кариес зуба), пульпитов (смотри полный свод знаний), отитов (смотри полный свод знаний), и в особенности тонзиллитов (смотри полный свод знаний: Тонзиллит). Профилактика Пороки сердца приобретённые, формирующихся вследствие бактериального эндокардита (смотри полный свод знаний), сводится к полному излечению заболеваний, вызываемых гноеродными микроорганизмами и приводящих к этой тяжёлой патологии. Лечение должно проводиться адекватными бактериостатическими и бактерицидными средствами в достаточно высоких дозах в каждом случае затяжного течения или возникновения рецидивов. Прекращать лечение можно лишь в случае полного подавления гнойного процесса. Основная мера профилактики сифилитических пороков сердца — борьба с вен. заболеваниями, своевременная диагностика и энергичное лечение сифилиса (смотри полный свод знаний), проводимое по принятым схемам.
Вторичная профилактика, то есть предупреждение прогрессирования уже возникших макроструктурных изменений сердца, зависит от характера основного заболевания. Так, в СССР создана государственная система профилактики и лечения ревматизма, предусматривающая в том числе диспансерный контроль за состоянием больных и регулярное применение антибиотиков, а также противовоспалительных средств. Разработаны и широко применяются действенные схемы лечения сифилиса.
Как показали специальные научные исследования, эффективность первичной и вторичной профилактики Пороки сердца приобретённые в значительной мере определяется двумя факторами: систематическим повышением специальных знаний медицинского персонала, в первую очередь медицинских работников первичного звена здравоохранения и специальных служб (кардиологической, кардиоревматологической, дерматовенерологической), а также высококвалифицированной организацией санитарного просвещения населения и разъяснительной работы среди больных.
Трудоспособность и реабилитация. Трудоспособность больных с Пороки сердца приобретённые определяется активностью патологического процесса, лежащего в основе порока, его характером и состоянием гемодинамики. Хотя известны многочисленные случаи, когда больные с Пороки сердца приобретённые в течение многих лет занимались тяжёлым физическим трудом и достигали выдающихся спортивных результатов, в принципе это всегда противопоказано, так как те или иные отделы сердца этих больных, даже находящихся в покое, испытывают постоянную дополнительную нагрузку объёмом или давлением. При полном отсутствии активности процесса и признаков латентной сердечной недостаточности (смотри полный свод знаний) больные могут заниматься лёгким физическим трудом, а также умственной деятельностью; ни в том, ни в другом случае недопустимо перенапряжение или переутомление. Латентная сердечная недостаточность значительно ограничивает физическую деятельность больного и возможность заниматься интенсивным умственным трудом. Это касается и больных, которых удалось вывести из состояния выраженной сердечной недостаточности. Клинически манифестирующая сердечная недостаточность, а также активность основного патологического процесса делают больного нетрудоспособным, а при сердечной недостаточности III стадии резко снижается возможность ухода за собой.
Вопросы реабилитации больных с Пороки сердца приобретённые находятся в стадии разработки, они стали особенно актуальными в связи с созданием эффективных оперативных методов лечения. Большое значение имеет психическая реабилитация (смотри полный свод знаний: Психиатрическая помощь), поскольку у больных с пороками сердца в результате хронического заболевания, сопровождающегося фрустрацией (сочетание подавленного настроения с напряжением и тревогой), ощущением безысходности, а нередко и органическими поражениями центральной нервной системы (гипоксия или ревматический васкулит сосудов головного мозга), нередки стойкие нарушения психики. Темпы и интенсивность физической реабилитации определяются влиянием операции на центральную и общую гемодинамику, состоянием сократимости миокарда, а также реакцией больного на дозированную физическую нагрузку в динамике.
Особенности приобретённых пороков сердца у детей
Пороки сердца приобретённые у детей формируются почти исключительно при ревматизме (смотри полный свод знаний), чаще в школьном возрасте; до 3 лет они практически не встречаются. Очень редкими причинами Пороки сердца приобретённые в детском возрасте могут быть затяжной септический эндокардит, сепсис, системная красная волчанка, ревматоидный артрит, склеродермия, вирусные кардиты, фиброэластоз, опухоли, травмы. В 1/3 случаев Пороки сердца приобретённые образуются в результате латентного течения ревматического процесса. После первого острого приступа ревматизма формирование Пороки сердца приобретённые наблюдается в 9—13% случаев, при затяжном течении в 3 раза чаще, а при повторных атаках в 34— 67%. При наличии симптомов клапанного поражения в фазе стихания эндокардита принято говорить о формирующемся пороке сердца. Сформированные Пороки сердца приобретённые диагностируют не ранее чем через год после атаки ревматизма.
В структуре Пороки сердца приобретённые у детей изолированная митральная недостаточность составляет, по разным данным, от 26,8 до 73%, сочетанный митральный порок — 16,8—43,3%; изолированный митральный стеноз — 1,04—3,2%; аортальная недостаточность — 5,45—10%; аортальный стеноз — до 1,36%.
Аортальный стеноз у детей редко бывает изолированным. Несколько чаще наблюдается сочетанный аортальный порок (обычно с преобладанием аортальной недостаточности) либо комбинация митрального и аортального стенозов (как правило, с преобладанием митрального). Органические пороки трёхстворчатого и особенно пульмонального клапанов встречаются крайне редко. Редко (в основном у подростков) наблюдается комбинация митральных пороков (обычно преобладающих) с трикуспидальными пороками. Частота сочетанных и комбинированных Пороки сердца приобретённые нарастает лишь в подростковом возрасте.
Клинические проявления приобретённых пороков сердца у детей характеризуются более чёткой, чем у взрослых, динамикой симптомов по мере формирования порока, становления компенсаторных процессов и развития декомпенсации. Этим обосновывается тенденция к выделению стадий наиболее частых Пороки сердца приобретённые у детей не только в кардиохирургической, но и в обще-педиатрической практике, хотя такой подход ещё не является общепринятым.
Митральная недостаточность — один из наиболее частых Пороки сердца приобретённые у детей, выявляемых после первой атаки ревматизма. В I стадии порока жалобы отсутствуют. Границы сердца в пределах возрастной нормы. Аускультативно и на ФКГ отмечается систолический шум у верхушки и в V точке убывающего характера, связанный с I тоном. На рентгенокимограммах возможно небольшое увеличение зубцов левого предсердия и левого желудочка. ЭКГ без патологический изменений.
Во II стадии порока у больных появляется небольшая одышка при физической нагрузке. Верхушечный толчок сердца несколько усилен и смещён влево. Умеренно увеличены левые отделы сердца. Аускультативная картина такая же, как у взрослых (смотри полный свод знаний: таблицу). Рентгенологически отмечается некоторое усиление сосудистого рисунка и гомогенизация корней лёгких, на рентгенокимограммах — повышенная пульсация и деформация зубцов по левому контуру сердца, симптом систолической экспансии. На ЭКГ — начальные признаки гипертрофии левых предсердия и желудочка.
III стадия порока характеризуется постоянством жалоб на утомляемость, одышку при умеренной нагрузке. Верхушечный толчок усиленный, иногда разлитой, смещён влево и вниз. Границы сердца расширены влево, вверх и вниз. Наряду с выраженным, часто голосистолическим, шумом, скрывающим I тон, у верхушки нередко выслушиваются мезодиастолический шум и III тон за счёт повышенного наполнения левого желудочка. Несколько увеличены размеры печени. Рентгенологически в лёгких — симптомы центрального венозного застоя; имеются также чёткие признаки гипертрофии левых отделов сердца и в меньшей степени — правого желудочка, выявляемые и на ЭКГ.
В IV стадии порока отмечаются похудание, легко возникающая одышка, часто — facies mitralis (смотри полный свод знаний: Habitus). Могут быть кардиалгии, сердцебиения, кровохарканье. Определяются разлитой верхушечный толчок сердца, некоторое выбухание и пульсация сердечной области. Присоединяются симптомы относительной трикуспидальной недостаточности; нередко появляется мерцательная аритмия (смотри полный свод знаний), на фоне которой нарастают признаки правожелудочковой сердечной недостаточности (смотри полный свод знаний)» Рентгенологически определяется кардиомегалия и выраженные признаки застоя в лёгких. На ЭКГ — выраженная гипертрофия и признаки дистрофии миокарда обоих желудочков и предсердий.
В V стадии порока, которая в детском возрасте наблюдается редко, развивается тяжёлое, необратимое, тотальное нарушение кровообращения и дистрофические изменения в различных внутренних органах. В IV и V стадиях порока в связи с резкой атриомегалией возникают симптомы относительного митрального стеноза. При этом иногда III тон принимается за «тон открытия» и возможна ошибочная диагностика истинного стеноза. Дифференциальный диагноз проводится по тем же признакам, что и у взрослых.
У детей чаще, чем у взрослых, возникает необходимость дифференцировать митральную недостаточность с врождёнными пороками сердца — септальными дефектами, атриовентрикулярной коммуникацией, пролапсом митрального клапана, а также с функциональными систолическими шумами (смотри полный свод знаний: Пороки сердца врождённые, Сердечные шумы).
Митральный стеноз рано проявляется гемодинамическими нарушениями, так как у детей характерно раннее развитие лёгочной артериальной гипертензии. Уже в I стадии порока наблюдаются утомляемость, некоторый цианотический оттенок губ, ногтей. Границы сердца расширены только вверх. У верхушки и в V точке определяется умеренный акцент I тона, диастолический шум с пресистолическим усилением, которое лучше выявляется при повороте ребёнка на левый бок и после нагрузки. Над лёгочным стволом рано появляется усиление и акцент II тона. Рентгенологически — расширение вен верхних лёгочных полей, позже наступает сужение венозных сосудов в нижних отделах. На ЭКГ — начальные признаки гипертрофии левого предсердия. Во II стадии порока отмечаются одышка при умеренной нагрузке, бледность; более заметен цианоз. У отдельных больных уже в этой стадии возникают острые приступы отёка лёгких (смотри полный свод знаний). При мало изменённых поперечных размерах сердца пальпация выявляет разлитой сердечный толчок, пресистолическое дрожание. Выслушивается выраженное усиление I тона у верхушки сердца и II тона над лёгочным стволом, диастолический шум. На ФКГ нередко определяется «тон открытия»; систолический шум, как правило, отсутствует; в диастоле имеется пауза между протодиастолическим шумом (чаще ранним мезодиастолическим, начинающимся после «тона открытия») и пресистолическим. На ЭКГ — гипертрофия левого предсердия. Рентгенологически — признаки артериальной лёгочной гипертензии, преобладание дуги лёгочной артерии по левому контуру сердца (вторая дуга больше третьей).
В III стадии порока у больных нарастают одышка, цианоз; часты жалобы на боли в груди, отмечается похудание; возможно кровохарканье; у ¼ детей периодически возникают острые приступы отёка лёгких, возможны застойные хрипы, которые нередко обусловливают гипердиагностику пневмонии. У отдельных больных имеется набухание шейных вен, увеличение печени. Отмечаются некоторое выбухание и пульсация сердечной области, расширение границ сердца вверх, в меньшей степени вправо. Выражено пресистолическое дрожание. Аускультативно синусовый ритм обычно сохранен; выслушивается резкое усиление I тона у верхушки сердца и II тона над лёгочным стволом, «тон открытия» и сплошной диастолический шум с пресистолическим усилением. Может выявляться нежный шум Грэма Стилла (относительная недостаточность клапана лёгочного ствола), симулирующий аортальную недостаточность. Рентгенологически — значительная гипертрофия левого предсердия и правых отделов сердца; в лёгких — признаки артериальной гипертензии, выраженный венозный застой и лимфостаз (гомогенизация корней, нечёткий сосудистый рисунок, нередко плевральные линии, линии Керли). Резкие нарушения лёгочной гемодинамики сочетаются с умеренным расширением границ сердца в переднезадней проекции; снижена контрастность сердечной тени на уровне левого желудочка, имеется свободный треугольник на его уровне во II косой проекции. На ЭКГ — признаки гипертрофии левого предсердия и правого желудочка.
В IV стадии порока у больных отмечаются одышка при малейшем напряжении, частые кардиалгии, сердцебиения, кашель; у ¼ — кровохарканье, часто наблюдается истощение, отставание в физическом и половом развитии. Выражен акроцианоз, однако типичное facies mitralis наблюдается реже, чем у взрослых. В связи с податливостью грудной стенки выражен сердечный горб. Периферические отеки не характерны. Инфарктная пневмония и артериальные эмболии очень редки, но возможны приступы отёка лёгких, которые у взрослых в этой стадии декомпенсации порока обычно прекращаются. Аускультативно сохраняется типичная мелодия митрального стеноза, часто шум Грэма Стилла и грубый систолический шум относительной трикуспидальной недостаточности. На ЭКГ — значительная гипертрофия и дистрофия миокарда обоих предсердий и правого желудочка. Мерцательная аритмия отмечается редко, так как детей обычно оперируют до её развития. По той же причине переход в V — терминальную стадию порока в детском возрасте отмечается исключительно редко. Афонический и систолический варианты митрального стеноза, как правило, не наблюдаются.
Дифференциальный диагноз проводится, как и у взрослых, с другими Пороки сердца приобретённые, относительным митральным стенозом, опухолевыми процессами, суживающими митральное отверстие, а также с активным кардитом, когда из-за отёка и инфильтрации клапанных структур и прилежащих отделав миокарда у 17% детей наряду с систолическим появляется мезодиастолический шум. Этот шум, как правило, исчезает в динамике на фоне настойчивой медикаментозно-гормональной терапии. Исключается синдром Лютамбаше.
Сочетанный митральный порок распознают, как и у взрослых, по одновременному наличию признаков как митрального стеноза, так н митральной недостаточности. При паритетной их выраженности (то есть без преобладания стеноза или недостаточности) характерны более ранние кардиальные жалобы, акроцианоз и сравнительно редкое развитие отёка лёгких; определяется пресистолическое дрожание, но при этом верхушечный толчок усилен, смещён влево; мелодия митрального стеноза менее звучная и сочетается с характерным систолическим шумом и наличием III тона. На ЭКГ отмечается нивелировка изменений электрической оси сердца, связанных с каждым из пороков, и признаки гипертрофии всех отделов сердца, в том числе левого желудочка. Рентгенологически обнаруживается более раннее, чем при изолированном митральном стенозе, развитие атриомегалии и кардиомегалии при меньшем выбухании лёгочного ствола по левому контуру сердца.
Аортальная недостаточность у детей характеризуется ранним появлением периферических симптомов (капиллярный пульс, снижение диастолического АД, скорый и высокий пульс и другие) и нежного протодиастолического шума в III — IV межреберьях у левого края грудины. В I стадии порока может быть небольшое расширение левой границы сердца и усиление верхушечного толчка. Во II стадии порока отмечается небольшая одышка при физической нагрузке, бледность. Верхушечный толчок смещён влево и вниз за счёт выраженной гипертрофии левого желудочка. Отчётливо выражен протодиастолический шум. Может появиться слабый систолический шум относительного аортального стеноза. Рентгенологически в этой стадии характерны аортальная конфигурация сердца, расширение и усиленная пульсация восходящей аорты.
В III стадии порока одышка имеется и при небольшой нагрузке; отмечаются утомляемость, иногда сердцебиения, боли в области сердца, отставание в физическом развитии. Периферические симптомы выражены значительно, в том числе пульсация шейных артерий, увеличение пульсового давления, иногда тоны Траубе, двойной шум Дюрозье. Однако, как правило, нет симптомов Мюссе, Мюллера, Ландольфи (смотри полный свод знаний: таблицу), пульсации печени и селезёнки. Границы сердца расширены влево, вниз и отчасти вправо. Усиленный, смещённый влево и вниз верхушечный толчок становится разлитым. Протодиастолический шум выслушивается над всей областью сердца с эпицентром во втором — третьем межреберьях. Возможно ослабление II тона на аорте. Нередко появляются отчётливые систолические шумы относительного аортального стеноза (во втором межреберье справа) и относительной митральной недостаточности (у верхушки), что может быть причиной гипердиагностики комбинированного порока сердца. Шум Флинта у детей отмечается редко. Рентгенологически определяется застой в лёгких. На ЭКГ — значительная гипертрофия левых отделов и в меньшей степени — правого желудочка, признаки дистрофии миокарда.
Тяжёлые стадии аортальной недостаточности, декомпенсация кровообращения по малому кругу (приступы сердечной астмы, отёк лёгких) и тем более по большому кругу в детском возрасте развиваются очень редко, так как детей либо оперируют, либо они успевают стать взрослыми.
Дифференциальный диагноз проводится с врождёнными пороками сердца, в частности с открытым артериальным протоком (смотри полный свод знаний), иногда с коарктацией аорты (смотри полный свод знаний) и поражениями аортального клапана при кардите, которые могут сопровождаться аналогичными периферическими симптомами.
Комбинированные приобретённые пороки сердца у детей встречаются в основном в виде разных вариантов митрально-аортального порока. Если аортальный порок представлен при этом недостаточностью аортального клапана, то в клинические, картине у детей, как правило, преобладают проявления митрального порока. Как и у взрослых, диагностика комбинированных пороков основывается на выявлении признаков, свойственных каждому из пороков.
. Лечение детей с Пороки сердца приобретённые основывается на тех же принципах, что и лечение взрослых. Дети с установленными Пороки сердца приобретённые находятся под постоянным наблюдением кардиоревматолога, а при необходимости их консультирует кардиохирург для определения показаний к операции, желательных её сроков и методики предоперационной подготовки.
После установления диагноза порока сердца и начала активного применения ЛФК особое внимание уделяют контролю за адекватностью выполняемой ребёнком физической нагрузки, добиться ограничения которой у детей бывает иногда труднее, чем у взрослых. В III стадии проявлений любого из Пороки сердца приобретённые больной ребёнок должен иметь дополнительные дни отдыха в школе; он освобождается от уроков физкультуры, спортивных соревнований, дальних походов, выполняя облегчённые комплексы ЛФК. В этой стадии при Пороки сердца приобретённые, сопровождающихся гиперфункцией и гипертрофией миокарда желудочков сердца, показана профилактическая дигитализация. Сердечный гликозид подбирают с учётом влияния его на автоматизм сердца (что важно, например, при аортальной недостаточности), проводимость (при её нарушениях или при мерцательной аритмии) и возможность сочетания с другими лекарствами, если возникает необходимость в их применении (обострение ревматизма, интеркуррентные заболевания). В IV—V стадиях проявлений Пороки сердца приобретённые, кроме лечения сердечной недостаточности (смотри полный свод знаний), осуществляют, как и у взрослых, профилактику и лечение возникающих осложнений.
Хирургическое лечение больных с приобретёнными пороками сердца
Для оказания хирургической помощи больным с пороками и заболеваниями сердца в СССР создана специальная сеть кардиохирургических центров (отделений). К 1980 год эту помощь в стране осуществляли 47 центров сердечно-сосудистой хирургии, созданных на клинические, базах медицинских НИИ и вузов. Центры оснащены специальным инструментарием для операций на сердце, шовным материалом, различными видами клапанных протезов и обязательно аппаратами искусственного кровообращения. Крупные центры сердечной хирургии позволяют совместить усилия врачей разных профилей — кардиохирургов, кардиологов, анестезиологов, реаниматологов, физиологов и других специалистов, направленные на обеспечение максимальной эффективности производимых операций при снижении риска их возможных осложнений.
История развития современной кардиохирургии в значительной мере связана с созданием методов хирургического лечения Пороки сердца приобретённые, в частности митрального стеноза. Попытки облегчить течение этого наиболее частого Пороки сердца приобретённые и прогностически неблагоприятного порока сердца с помощью паллиативных операций (создание различного рода анастомозов между левым желудочком и лёгочной веной или левым предсердием и другие) осуществлялись уже в начале 20 век Одну из удачных паллиативных операций разработали в 1948 год Коссио и Перианес (P. Cossio, I. Perianes), которые предложили перевязку нижней полой вены непосредственно перед впадением в неё печёночных вен. Больные после этой операции отмечали улучшение самочувствия, уменьшение одышки, улучшалась сократительная функция правого сердца, снижалось венозное давление, улучшалась функция почек. Однако этот эффект редко бывал устойчивым.
Прямое вмешательство на митральном клапане впервые осуществил Калтер (Е. S. Culter) в 1923 год Он произвёл частичное выкусывание спаянных створок митрального клапана вальвулотомом собственной конструкции доступом через стенку левого желудочка; в результате создавалась определённая степень недостаточности клапана. Менее травматично стеноз устраняется не путём выкусывания створок, а разделением спаянных комиссур, то есть комиссуротомией. В 1925 год Суттар (Н. S. Souttar) впервые успешно расширил митральное отверстие пальцем, введённым в разрез левого ушка. В 1926 год И. П. Дмитриев на трупах и в эксперименте на животных доказал целесообразность подхода к митральному клапану через ушко левого предсердия. В 1948 год Бейли (С. Р. Bailey) с помощью комиссуротома, а Р. Брок пальцем успешно произвели митральную комиссуротомию, которая с тех пор получила повсеместное распространение. В СССР эту операцию впервые произвёл в 1952 год А. Н. Бакулев, а в 1953 год— Б. В. Петровский. Успешность операции комиссуротомии при митральных стенозах предопределила разработку методов аналогичных операций на других клапанах сердца, а прогресс анестезиологии и создание эффективных систем обеспечения искусственного кровообращения, а также развитие хирургической техники способствовали созданию новых хирургических методов лечения Пороки сердца приобретённые
К 80-м годы 20 век наибольшее распространение получили следующие основные виды хирургического лечения Пороки сердца приобретённые: 1. Комиссуротомия, осуществляемая с целью уменьшения степени стеноза на уровне поражённого клапана путём разъединения его спаянных створок. Её выполняют в вариантах так называемый Закрытой комиссуротомии (расширение суженного клапанного отверстия без визуального контроля) и открытой комиссуротомии, то есть под контролем зрения в условиях искусственного кровообращения (смотри полный свод знаний). 2. Пластические операции на клапанах, производимые в условиях искусственного кровообращения с целью восстановления или улучшения функции поражённого клапана сердца, чаще всего в виде вальвулопластики (смотри полный свод знаний) при открытой комиссуротомии или анулопластики с помощью швов или опорных колец. 3. Протезирование сердечных клапанов, осуществляемое в случаях, когда с помощью других хирургических операций восстановление функции клапана из-за особенностей его поражения невозможно (смотри полный свод знаний: Протезирование клапанов сердца).
Основными и наиболее общими для всех Пороки сердца приобретённые показаниями к оперативному лечению являются развитие или ближайшая угроза витально опасных для больного осложнений, обусловленных непосредственно самим пороком: угроза необратимой сердечной недостаточности, рецидивирующий отёк лёгких, повторяющиеся тромбоэмболии (например, из-за тромба в левом предсердии при митральном стенозе) и так далее Поскольку аналогичные нарушения могут быть обусловлены не пороком сердца, а другими причинами (активный ревматический кардит, сопутствующие заболевания и другие) то установление показаний к оперативному лечению Пороки сердца приобретённые основывается на тщательной дооперационной диагностике не только формы порока, но и степени нарушения клапанной функции (т. е. степени недостаточности клапана или степени стеноза соответствующего отверстия), а также, по возможности, характера и выраженности анатомических изменений клапана (рубцовые деформации, кальциноз). Определению показаний к хирургическому лечению Пороки сердца приобретённые существенно помогает деление гемодинамических нарушений на степени или стадии, аналогичное классификации митрального стеноза, разработанной А. Н. Бакулевым и Е. А. Дамир (1955): I ст. — латентная (одышки нет даже при физической нагрузке, кровообращение полностью компенсировано); II ст.— при физической нагрузке возникают признаки нарушения гемодинамики в малом круге кровообращения, нарастает растяжение левого предсердия, гипертензия малого круга, склероз лёгочной артерии; III ст.— в малом круге выраженные признаки нарушения кровообращения, в большом — начальные проявления застоя; IV степени — постоянный застой в большом круге кровообращения, отеки, асцит, снижение сократительной способности миокарда; V степени — дистрофическая стадия недостаточности кровообращения, соответствующая III стадии по классификации Н. Д. Стражеско и В. X. Василенко.
Согласно приведённой классификации оперативному лечению подлежат больные со II, III и IV степенью нарушения гемодинамики.
Б. В. Петровский выделяет следующие группы проявлений митрального порока:
I группа — резкий митральный стеноз без недостаточности (диаметр отверстия 0,4—0,6 сантиметров) II группа — выраженный митральный стеноз с умеренной недостаточностью (диаметр отверстия 0,6—1,0 сантиметров, регургитация +); III группа — стеноз и недостаточность выражены в равной степени (диаметр отверстия 1,0—1,8 сантиметров, регургитация ++); IV группа — чистая недостаточность митрального клапана (регургитация определяется в ушке левого предсердия); V группа — сочетание митрального стеноза с поражениями других клапанов.
Противопоказаниями к хирургическому лечению являются обострение ревматического кардита в высокой степени активности, текущий бактериальный эндокардит (до завершения их консервативного лечения), а также выраженная степень сердечной недостаточности с истощением компенсаторных резервов, при которой витальный прогноз хирургическим вмешательством существенно не улучшается и не оправдывает риск операции. В некоторых случаях по жизненным показаниям операцию производят и при явно активном ревмокардите.
Вид оперативного вмешательства при установлении показаний и исключении противопоказаний к хирургическому лечению избирается в зависимости от клинические, формы порока, степени органических изменений поражённых клапанов и с учётом общего состояния пациента. Из основных видов оперативного лечения Пороки сердца приобретённые, описываемых ниже, технически наиболее разработана закрытая комиссуротомия, особенно при митральном стенозе (в разных вариантах доступа к митральному клапану). Пластические операции на клапанах и протезирование клапанов осуществляются реже, чем комиссуротомия, не только из-за своей сложности, но и из-за меньшей частоты пороков сердца, подлежащих такому оперативному лечению, по сравнению с частотой митрального стеноза. Техника этих операций требует ещё значительного совершенствования. Особенности обезболивания при операциях — смотри, полный свод знаний: Сердце, особенности обезболивания при операциях на сердце.
Закрытая комиссуротомия при митральном стенозе. Оперативное лечение митрального стеноза безусловно показано при сужении левого атриовентрикулярного отверстия до диаметром 1,5 сантиметров и менее. Наиболее оптимальные условия для операции возникают при II степени нарушения кровообращения по А. Н. Бакулеву и Е. А. Дамир, когда расстройства гемодинамики, связанные с уже резким стенозом, ограничиваются пока только пределами малого круга кровообращения. Операция, произведённая в этой стадии, сопряжена с наименьшим риском. При часто рецидивирующем отёке лёгких необходимо незамедлительно производить митральную комиссуротомию. Далеко зашедшие изменения в лёгочных сосудах не являются противопоказанием к комиссуротомии, ибо у больных с лёгочной гипертензией после операции практически всегда наступает значительное улучшение состояния здоровья.
Беременность не увеличивает операционного риска, а вмешательство на сердце не создаёт дополнительных опасностей для плода. Лучше всего оперировать на III — IV месяцев беременности. На VII—VIII месяцев оперировать не следует, так как в это время система кровообращения испытывает самую большую нагрузку. В последние месяцы беременности существует опасность преждевременных родов; кроме того, слишком короток период от оперативного вмешательства до родов, чтобы получить эффект от операции. В последние месяцы беременности, если имеются показания к митральной комиссуротомии, больной необходимо в первую очередь выполнить кесарево сечение (смотри полный свод знаний), а потом уже вмешательство на сердце.
Если по характеру поражения митрального клапана не требуется его протезирование или открытая комиссуротомия, то производится закрытая комиссуротомия, цель которой — максимально возможное расширение суженного отверстия с помощью комиссуротома или дилататора (смотри полный свод знаний: Расширители) и пальца хирурга. Ещё случающаяся рекомендация обязательно расширять отверстие до стенок сердца опасна, так как полный разрыв анатомических комиссур приводит к нарушению запирательной функции мембраны. При закрытой комиссуротомии применение дилататора должно быть поэтапным и сочетаться с действиями пальца хирурга. Максимальное разведение браншей инструмента не должно превышать сопротивление на разрыв анатомических комиссур, оснований створок и фиброзного кольца.
Для закрытой комиссуротомии применяют несколько способов доступа к митральному клапану. Обобщённо их разделяют на левосторонний (чреспредсердный и чрезжелудочковый) и правосторонний доступы.
Обезболивание при митральной комиссуротомии — эндотрахеальный наркоз (смотри полный свод знаний: Ингаляционный наркоз). Оно проводится с учётом особенностей гемодинамики, обусловленных митральным стенозом. При укладке больного и во время операции исключают возвышенное положение нижних конечностей и таза, чтобы избежать увеличения притока крови к лёгким за счёт гравитационного фактора. Закись азота у больных с выраженной лёгочной гиперволемией может усугубить гемодинамические нарушения. Поэтому её в этих случаях либо не применяют, либо применяют ограниченно и при тщательном контроле за гемодинамикой (чтобы при необходимости своевременно прекратить подачу газа). Избегают также средств анестезии, учащающих сердечные сокращения, так как при митральном стенозе это может за счёт укорочения диастолы резко уменьшить наполнение левого желудочка. Для поддержания во время операции редкого темпа сердцебиений используют сердечные гликозиды и пропранолол. Особое внимание уделяется адекватной оксигенации больных, так как снижение концентрации кислорода в газовой смеси и гипоксемия у больных с митральным стенозом увеличивают вазоконстрикцию в лёгких (рост лёгочной гипертензии с угрозой развития правожелудочковой недостаточности) и способствуют повышению проницаемости капилляров, что может привести к отеку лёгких.
Комиссуротомия при левостороннем чреспредсердном доступе. Операцию производят в положении больного на правом боку. Грудную клетку вскрывают широко по четвёртому межреберью. Кожный разрез делают от края грудины до задней лопаточной линии с частичным рассечением широкой мышцы спины. Плевру вскрывают рассечением межрёберных мышц. Лёгкое отодвигают в сторону при помощи больших марлевых салфеток. Перикард вскрывают кзади и параллельно диафрагмальному нерву, чтобы в ране были отчётливо видны ушко, левое предсердие, лёгочный ствол и левый желудочек. Края перикарда берут на держалки и широко растягивают. Затем производят осмотр и ощупывание сердца и крупных сосудов; лёгочный ствол и лёгочные вены обычно резко расширены, напряжены; ушко левого предсердия часто бывает увеличенным. Однако при тромбозе ушко, наоборот, уменьшено и сморщено. Верхушку ушка захватывают окончатым зажимом, на основание ушка накладывают кисетный шёлковый шов и зажим Сатинского, затем на переднюю и заднюю стенки ушка — швы-держалки (рисунок 23, а). Верхушку ушка отсекают, а через отверстие в ушке вводят палец (рисунок 23, б), который после снятия зажима Сатинского проводится в полость левого предсердия. Введённым указательным пальцем хирург производит ревизию митрального клапана и осуществляет митральную комиссуротомию путём прямого давления пальцем на край каждой комиссуры, добиваясь её разделения, по возможности, до фиброзного кольца. Отверстие должно быть расширено до 3,5—4,5 сантиметров. Если пальцем не удаётся произвести разделение комиссур вследствие их омозолелости, выраженного фиброза створок, прибегают к инструментальной комиссуротомии с помощью специальных комиссуротомов, которые вводят в левое предсердие вместе с пальцем, либо прибегают к чрезжелудочковой комиссуротомии (смотри полный свод знаний: ниже) с использованием дилататора Дюбо. После комиссуротомии палец проводят дальше в левый желудочек, определяя, нет ли подклапанных сращений хорд и папиллярных мышц. Имеющиеся сращения разъединяют пальцем. После этого палец извлекают; на основание ушка накладывают лигатуру (рисунок 23, в). Закрытие раны в ушке производят путём затягивания кисетного шва, либо наложением круговой лигатуры, либо прошиванием скрепочным аппаратом. Избыточную часть ушка отсекают (рисунок 23, г) и на края раны ушка накладывают несколько узловатых швов (рисунок 23, д). Полость перикарда промывают физиологическим раствором. Перикард ушивают редкими швами с оставлением окна в нем для дренирования. Для уменьшения болей в первые дни после операции производят спирт-новокаиновую блокаду нервов в третьем, четвёртом и пятом межреберьях у заднего края раны. Через дополнительный прокол в плевральную полость вводят резиновый дренаж. Плевральную полость зашивают послойно наглухо.
Комиссуротомия при тромбозе левого предсердия, обнаруженном при левостороннем доступе, осуществляется с некоторыми особенностями отдельных этапов операции. Весьма ответственным моментом вмешательства является внешнее обследование ушка. В большинстве случаев ушко при тромбозе маленькое, сморщенное, непульсирующее и плотное на ощупь, если содержит старый организованный тромб. При наличии свежих, рыхло спаянных с эндокардом тромботических масс, ушко выглядит неизменённым, больших размеров. При тотальном тромбозе ушко напряжено и вздуто. При пальпации свободное от тромба ушко легко спадается, а ушко, содержащее тромб, не спадается и прощупывается в виде бесформенной массы различной плотности в зависимости от степени организации тромба. Очень сложно распознать маленькие, свежие и особенно пристеночные тромбы ушка с продолжением их в предсердие.
При установлении тромбоза левого предсердия на основание ушка накладывают не зажим Сатинского (во избежание раздавливания тромботических масс), а кисетный шов (рисунок 24, а), который закрепляется в турникете Руммеля. Кисетный шов стараются наложить у самого основания ушка, а при маленьких его размерах и узкой шейке — с использованием стенки предсердия по латеральному краю. Затем на ушко накладывают 4—5 шёлковых держалок: одну на верхушку, по одной на наружно-боковые стенки и одну или две — на наружную стенку ближе к основанию так, чтобы не прошить прилегающие тромботические массы. Скальпелем широко рассекают латеральную стенку ушка между держалками (рисунок 24, б). Очень важно сразу широко вскрыть ушко, чтобы разрез свободно пропускал указательный палец. Если тромбы обнаруживаются в полости предсердия вне ушка (чаще они бывают смешанного характера и располагаются на задней стенке между основанием ушка и лёгочной веной), то тромбэктомию следует расчленить на два этапа. Вначале лопаточкой производят мобилизацию тромботических масс до появления кровотечения из ушка. Тромб удаляют на струе крови (рисунок 24, в). Затем кончиком указательного пальца, введённого в предсердие, захватывают оставшийся тромб предсердия со стороны его нижнего полюса, быстро смещают его в ушко, из которого он удаляется при извлечении пальца. При необходимости подобную манипуляцию повторяют 2—3 раза, всякий раз промывая ушко струёй крови. Нужно стараться удалять только свежие и смешанные внутрипредсердные тромбы; организованные сгустки, плотно сращённые с эндокардом, удалению не подлежат.
При удалении тромба из ушка и левого предсердия с целью профилактики тромбоэмболических осложнений анестезиолог в момент внутрисердечных манипуляций сдавливает сонные артерии на шее. Тромбэктомия всегда должна предшествовать митральной комиссуротомии, так как высокое давление в предсердии до расширения отверстия способствует быстрому вымыванию сгустков, а само сужение отверстия в какой-то степени препятствует попаданию в левый желудочек тромботических масс.
Осложнениями комиссуротомии при левостороннем чреспредсердном доступе могут быть артериальная тромбоэмболия и разрыв стенки ушка левого предсердия. По данным Н. Н. Малиновского с соавторами (1975), артериальная тромбоэмболия при этом способе комиссуротомии явилась основной причиной смерти 6,1% от общего числа оперированных больных, или 57% больных, имевших это осложнение. Причиной эмболии обычно является фрагментация тромботических масс и занос эмболов в большой круг кровообращения (в артерии мозга, коронарные артерии, на бифуркацию аорты, в артерии верхних и нижних конечностей, подвздошные артерии, артерии почек, артерию селезёнки). Поэтому при подозрении на тромбоз левого предсердия комиссуротомию следует производить либо в условиях искусственного кровообращения, либо используя правосторонний доступ. Источником артериальной эмболии может быть также и кальциноз створок митрального клапана.
Разрыв стенки ушка левого предсердия также нередкое осложнение комиссуротомии при левостороннем доступе. Чаще всего наблюдается продольный разрыв ушка, особенно при малых его размерах. Чтобы остановить кровотечение, обычно бывает достаточно затянуть кисетный шов либо наложить круговую лигатуру. Более опасным является разрыв ушка с переходом на стенку предсердия, так как чаще стенка предсердия рвётся в направлении венечной борозды. Лучшим методом остановки кровотечения в этих случаях является тампонада изнутри с помощью указательного пальца и наложение швов (рисунок 25).
Комиссуротомия при левостороннем чрезжелудочковом доступе с применением дилататора. Необходимость в применении дилататоров возникает при ригидном митральном клапане, при фиброзе его створок, когда пальцевая комиссуротомия часто не удаётся. Наиболее широко использовался двухлопастный дилататор Дюбо, применение которого возможно при чрезжелудочковом доступе к митральному клапану.
 |
|  |
Рис. 25. | ||
Техника операции. Положение больного на правом боку или на спине с валиком под левым боком. Грудную полость вскрывают по пятому межреберью. Расширение раны проводят с таким расчётом, чтобы был доступ к верхушке сердца. Перикард широко (от лёгочного ствола до верхушки сердца) вскрывают кпереди от диафрагмального нерва. Хирург вводит указательный палец в полость левого предсердия, производит ревизию митрального клапана, затем извлекает палец. На основание ушка накладывают зажим Сатинского. На стенку левого желудочка в бессосудистой зоне накладывают кисетный шов, концы которого берут в турникет. В центре кисетного шва скальпелем прокалывают стенку левого желудочка и в прокол вводят расширитель Дюбо (рисунок 26). Указательный палец правой руки после снятия зажима Сатинского вновь вводят в левое предсердие к митральному клапану, а дилататор Дюбо левой рукой продвигают к предсердно-желудочковому отверстию и под контролем пальца, находящегося в предсердии, проводят головку дилататора в отверстие. Сильным сжатием рукоятки дилататора разводят бранши инструмента и производят комиссуротомию. Пальцем, находящимся в предсердии, проверяют эффективность комиссуротомии. Дилататор извлекают, кисетный шов затягивают, останавливая таким путём кровотечение из левого желудочка. Палец из предсердия извлекают, на основание ушка накладывают зажим Сатинского, затем завязывают кисетный шов, подкрепляя рану 2—3 узловатыми швами. Ушко обрабатывают по описанной выше методике.
Инструментальная чрезжелудочковая митральная комиссуротомия редко даёт осложнения и в то же время является эффективным методом лечения митрального стеноза.
Комиссуротомия при правостороннем доступе. Зона сердца, используемая для правостороннего доступа к митральному клапану, является пограничной областью между правым и левым предсердиями на правой заднебоковой поверхности сердца. Анатомически она представлена межпредсердной бороздой, сформированной в результате соприкосновения и слияния листков миокарда предсердий. С формированием и развитием митрального стеноза происходит увеличение левого предсердия с общей ротацией сердца влево, при этом межпредсердная борозда выходит на правый контур сердца и становится легко доступной для расслоения из правостороннего доступа. Это создаёт анатомические предпосылки для доступа к двустворчатому клапану сердца и делает легко осуществимой правостороннюю митральную комиссуротомию.
Основными показаниями к применению правостороннего доступа к митральному клапану являются подозрение на внутрипредсердный тромбоз, рестеноз левого атриовентрикулярного отверстия, а также митрально-трикуспидальный стеноз (для одновременной комиссуротомии) и сочетание митрального стеноза с патологией в правой плевральной полости (правом лёгком).
Техника операции. Доступ переднебоковой при положении больного на спине и с валиком под правой половиной грудной клетки. Разрез кожи, подкожной клетчатки и вскрытие плевральной полости производят по четвёртому межреберью от правого края грудины до средней подмышечной линии. Лёгкое отводят в сторону марлевой салфеткой. Вскрытие перикарда делают параллельно диафрагмальному нерву (на 1,5—2 сантиметров кпереди от него) на протяжении 8—10 сантиметров края перикарда берут на шёлковые держалки.
После отведения в сторону листков перикарда становятся отчётливо видны оба предсердия, граница между ними и устья полых вен (рисунок 27, а). Для свободной манипуляции в области межпредсердной перегородки правое предсердие, нависающее над левым, натягивается двумя тупферами кпереди и осторожно отводится к средней линии. Зона расслоения межпредсердной перегородки имеет вид неглубокой борозды. Спереди от неё расположен заворот миокарда правого предсердия, а сзади — узкая полоска левого предсердия с устьем правой лёгочной вены, сверху и снизу — устья полых вен. Часто на этом участке имеется подэпикардиальный жир жёлто-серой окраски, который и является главным опознавательным признаком места расслоения перикарда.
В проекции межпредсердной борозды скальпелем рассекают эпикард на глубину около 0,5 сантиметров разрезом длиной 2,0—2,5 сантиметров. Расслоение перегородки в дальнейшем производят пальцем; обычно перегородка легко расслаивается. При этом основной массив заворота миокарда правого предсердия с прилежащим к нему жиром отходит кпереди. Нижней стенкой образовавшейся щели является стенка левого предсердия, имеющая более светлую окраску и представляющая собой как бы продолжение передней стенки устьев лёгочных вен. На края расслоённой межпредсердной перегородки накладывают два кисетных шва. Иногда вместо кисетного шва накладывают только П-образный шов (рисунок 27, б). Один из кисетных швов проводится в турникет Руммеля. После наложения кисетных швов лопаточкой приподнимают и отодвигают кпереди верхний край расслоённой перегородки, чтобы хорошо была видна стенка левого предсердия. Перед проколом стенки предсердия проверяют, не попадает ли в разрез нить кисетных швов; прокол делают в центре кисетных швов острым и обязательно широким скальпелем, чтобы свободно можно было ввести в полость левого предсердия указательный палец и инструмент. При этом лезвие скальпеля обращают в сторону страхующей лопаточки — брюшком к правому предсердию. Лезвие скальпеля обычно вводят в полость предсердия на глубину 1,5—2 сантиметров. После извлечения скальпеля хирург тотчас же указательным пальцем левой руки (без перчатки), направленным перпендикулярно вниз, обтурирует раневое отверстие и начинает постепенно вводить палец в полость предсердия. Ревизия митрального отверстия и комиссуротомия возможны только тогда, когда указательный палец хирурга введён в левое предсердие на достаточную глубину, то есть до уровня сустава между основной и средней фалангами. Митральный клапан обнаруживают по направлению к верхушке сердца и немного кпереди от неё, на расстоянии 6—8 сантиметров от места введения пальца. Одно из важных преимуществ этого доступа состоит в том, что противоположная стенка левого предсердия и ушко с локализующимися в них тромбами находятся от места введения пальца на расстоянии около 8—10 сантиметров и расширение митрального отверстия производят в обход тромботических масс.
При правостороннем доступе выполнить комиссуротомию пальцем почти невозможно, поэтому применяют различной конструкции дилататоры (смотри полный свод знаний: Расширители). Наибольшее распространение получил дилататор на гибком тросе конструкции К. В. Лапкина. Инструмент вводят в полость левого предсердия по пальцу. При этом ассистент берет ручку инструмента, а хирург правой рукой — тросик над головкой дилататора; для свободного прохождения головки инструмента через отверстие в стенке левого предсердия хирург частично извлекает из него указательный палец (до ногтевой фаланги), затем вместе с обратным движением пальца головка инструмента направляется в полость левого предсердия. После проникновения рабочей части инструмента в левое предсердие ассистент отводит рукоятку инструмента к предплечью левой руки хирурга. Хирург направляет пальцем головку инструмента к митральному клапану, одновременно двигая вперёд правой рукой тросик.
Таким же движением, установив головку инструмента в митральном отверстии, хирург оставляет трос и берет в правую руку рукоятку инструмента. Под контролем пальца устанавливается необходимая глубина рабочей части инструмента в митральном отверстии. Затем хирург, нажимая на рукоятку инструмента, производит комиссуротомию, после чего дилататор удаляют из полости левого предсердия и производят пальцевую ревизию митрального клапана и подклапанных структур. При наличии подклапанных сращений производят их разделение. После извлечения хирургом пальца из полости левого предсердия один из помощников затягивает турникет, а хирург завязывает оба кисетных шва, которые надёжно герметизируют левое предсердие и предупреждают кровотечение из операционной раны. Накладывают редкие швы на перикард. Производят спирт-новокаиновую блокаду межрёберных нервов. Послойно ушивают рану грудной клетки с оставлением дренажа в правом плевральном синусе.
Осложнениями комиссуротомии при правостороннем доступе могут быть тромбоэмболии и кровотечения, однако частота их значительно ниже, чем при операции из левостороннего доступа.
Закрытая комиссуротомия при митрально трикуспидальном стенозе. Необходимость в комиссуротомии трикуспидального клапана возникает обычно при комбинированных Пороки сердца приобретённые, чаще всего при митрально-трикуспидальном пороке сердца, так как изолированный трикуспидальный стеноз встречается весьма редко.
Показанием к трикуспидальной комиссуротомии является уменьшение площади правого атриовентрикулярного отверстия (в норме около 8 см²) не менее чем в 2 раза, что обычно уже сопровождается нарушениями общей гемодинамики. Противопоказанием может быть только крайне тяжёлое состояние больного.
При сочетании стеноза трёхстворчатого клапана с пороками других клапанов целесообразно вначале устранить митральный стеноз и аортальный (если он есть), а затем уже трикуспидальный. Обратная последовательность оперативного вмешательства может привести к внезапному переполнению кровью сосудов лёгких и правого желудочка с острой декомпенсацией гемодинамики.
Закрытая комиссуротомия одновременно на митральном и трикуспидальном клапанах применяется при комбинированном митрально-трикуспидальном стенозе, когда нет необходимости в большем объёме оперативного вмешательства. При этом используют правосторонний доступ.
Техника операции. Положение больного на спине с валиком под правым боком. Производят переднебоковую торакотомию справа по четвёртому межреберью. Перикард вскрывают кпереди от диафрагмального нерва. Доступ к митральному клапану осуществляют через межпредсердную перегородку. По завершении митральной комиссуротомии и восстановлении целостности межпредсердной перегородки на верхушку ушка правого предсердия накладывают окончатый зажим, а на основание ушка — зажим Сатинского. Ушко вскрывают отсечением его верхушки. На края разреза накладывают швы-держалки. В отверстие вводят указательный палец левой руки, которым и производят комиссуротомию трикуспидального клапана, при этом достаточно разъединить только две комиссуры: переднезаднюю и медиальнозаднюю. После комиссуротомии палец извлекают, на основание ушка накладывают зажим Сатинского; перевязывают ушко круговой лигатурой либо лигатурой с прошиванием. Рану грудной стенки зашивают наглухо с оставлением дренажа в плевральной полости.
Закрытая комиссуротомия при аортальном стенозе. Устранение аортального стеноза без контроля зрения нередко ведёт к созданию аортальной недостаточности, которая является причиной развития выраженной недостаточности кровообращения с летальным исходом. Поэтому при поражении аортального клапана операцией выбора является его протезирование в условиях искусственного кровообращения. Современная тенденция в кардиохирургии предполагает исключение закрытой аортальной комиссуротомии из арсенала оперативных методов лечения Пороки сердца приобретённые К 80-м годы 20 век применение этой операции в СССР стало весьма ограниченным.
Техника операции. Положение больного на спине с валиком под левым боком. Грудную полость вскрывают переднебоковым разрезом по пятому межреберью от грудины до задней подмышечной линии. Перикард вскрывают широким продольным разрезом кпереди от диафрагмального нерва.
На поверхности бессосудистого участка стенки левого желудочка в области верхушки сердца накладывают кисетный шов, концы которого берут в турникет. В центре участка, ограниченного кисетным швом, производят прокол стенки желудочка узким скальпелем, и в рану вводят расширитель. Головку расширителя проводят в клапанное отверстие, контролируя установку расширителя через стенку аорты пальцами левой руки. Когда головка расширителя установлена в зоне аортального клапана, бранши инструмента раздвигают на 2—2,5 сантиметров нажатием рукоятки, производят комиссуротомию.
В момент расширения браншей инструмента слышен характерный хруст. Инструмент удаляют при закрытых браншах; подтягивают кисетный шов, тем самым останавливая кровотечение. Рану желудочка зашивают шёлковыми швами.
Комиссуротомия и пластические операции на сердечных клапанах в условиях искусственного кровообращения. Создание надёжных аппаратов искусственного кровообращения (смотри полный свод знаний) и разработка метода искусственной гипотермии тела (смотри полный свод знаний: Гипотермия искусственная) обеспечили условия, при которых операции на сердечных клапанах могут производиться под контролем зрения, то есть открытым способом, и с использованием инструментов (скальпель, ножницы), значительно расширяющих возможности оперативного воздействия на изменённый клапан.
Открытая комиссуротомия позволяет: 1) максимально восстановить функцию за счёт наиболее адекватного разделения (в соответствии с анатомией) спаянных комиссур и обеспечения хорошей подвижности створок; 2) предупредить грубые повреждения клапанной мембраны и хордопапиллярных образований; 3) корригировать подстворочные сращения путём продольного расщепления папиллярных мышц и конгломератов хорд; 4) безопасно удалить тромбы из левого предсердия.
К пластическим операциям на клапанах сердца относят вальвулопластику при открытой комиссуротомии, восстановление дефектов створок при травме их, анулопластику с помощью швов или опорных колец. После пластических операций не возникает необходимости назначения антикоагулянтов, отсутствует опасность тромбоэмболий, септического эндокардита, не страдают форменные элементы крови.
Абсолютными показаниями к открытой комиссуротомии являются аортальный стеноз, тромбоз левого предсердия при митральном стенозе, рестеноз, кальциноз и другие грубые изменения поражённых клапанов (если эти изменения не достигают степени, требующей замены клапана протезом). Противопоказания при надёжной методике искусственного кровообращения не отличаются от таковых при закрытых способах операции.
Открытая митральная комиссуротомия все чаще производится не только по абсолютным показаниям к этому способу операции (внутрипредсердный тромбоз, кальциноз клапана, рестеноз), но и в связи с её преимуществами перед закрытой комиссуротомией по эффективности восстановления функции митрального клапана.
Техника операции. Доступ — продольная стернотомия. После вскрытия перикарда производят канюлирование полых вен. Один венозный катетер аппарата искусственного кровообращения (АИК) проводят через ушко правого предсердия, другой — через стенку правого предсердия. Артериальную магистраль аппарата искусственного кровообращения вводят в восходящую аорту.
В условиях искусственного кровообращения широко вскрывают левое предсердие ниже межпредсердной борозды, параллельно ей. После отсасывания крови из полости левого предсердия коронарным отсосом производят ревизию полости; имеющиеся тромботические массы удаляют ложкой или отсосом. После удаления тромбов оценивают состояние митрального клапана (рисунок 28) и производят комиссуротомию: специальными крючками приподнимают створки митрального клапана и скальпелем производят рассечение сросшихся створок строго по комиссурам. После завершения комиссуротомии визуально выполняют разделение подклапанных сращений. По окончании внутрисердечного этапа операции левое предсердие ушивают двухрядным швом (П-образным и обвивным). Удаляют венозные канюли.
В случае невозможности восстановить функцию клапана путём комиссуротомии (грубое поражение подклапанных структур, выраженный кальциноз клапана) производят замену клапана протезом (смотри полный свод знаний: ниже).
Анулопластика митрального клапана показана при митральных пороках, когда нарушение функции клапана обусловлено главным образом дилатацией фиброзного кольца при изменённых, но относительно сохранных створках, особенно передней.
Техника операции. Операция выполняется в условиях искусственного кровообращения, умеренной гипотермии (31°), Холодовой и фармакологической кардиоплегии (смотри полный свод знаний).
После срединной стернотомии и вскрытия перикарда АПК подключают путём канюляции восходящей аорты и раздельного дренирования полых вен, начиная перфузию, дренируют левый желудочек. При температуре тела больного 31° пережимают восходящую аорту, вызывают холодовую и фармакологических кардиоплегию. Левое предсердие вскрывают продольным разрезом. В области комиссур накладывают два П-образных шва. В окружности фиброзного кольца в зоне задней створки П-образные швы накладывают изнутри между хордами с использованием тефлоновых прокладок. В зоне передней створки на фиброзное кольцо накладывают 3—4 отдельных П-образных шва. Применяют полужёсткие синтетические и металлические кольца, обшитые плетёным найлоном. Кольцо фиксируют так, чтобы не деформировалось основание передней створки. Это достигается прошиванием кольца двумя П-образными швами, наложенными ранее в области комиссур таким образом, чтобы расстояние между швами на кольце соответствовало длине фиброзного кольца передней створки. Остальными швами последовательно прошивают кольцо на других участках. После погружения кольца в митральную позицию швы завязывают, начиная с комиссур и зоны передней створки. Кольцо в области основания передней створки дополнительно фиксируют непрерывным обвивным швом. Левое предсердие ушивают П-образным и обвивным швами.
Пластические операции при трикусиидальных пороках получают все большее распространение из-за неудовлетворительных результатов операций замещения трикуспидального клапана и расширения показаний к оперативному лечению этих пороков в связи с установлением несостоятельности существовавшего ранее представления о небольшой гемодинамической значимости нерезко выраженного трикуспидального порока. В патогенезе недостаточности кровообращения при Пороки сердца приобретённые нередко занимает одно из ведущих мест органическое поражение трикуспидального клапана (обычно при комбинированных пороках) и особенно часто — так называемый относительная трикуспидальная недостаточность. Органическое поражение трикуспидального клапана состоит в утолщении и укорочении створок, сращении комиссур, укорочении хорд. Может быть резкий стеноз без регургитации, комбинация стеноза с незначительной или умеренной регургитацией. Недостаточность клапана наступает при ограничении подвижности и уменьшении площади створок за счёт их склероза и расширения фиброзного кольца. Относительная трикуспидальная недостаточность определяется при значительном расширении фиброзного кольца при неизменённых подвижных створках и подклапанных структурах.
Для коррекции трикуспидального порока используются различные пластические операции.
Открытая трикуспидальная комиссуротомия производится в условиях искусственного кровообращения и предусматривает рассечение сросшихся створок строго по комиссурам под контролем зрения.
В условиях искусственного кровообращения возможна анулопластика, производимая путём наложения П-образных швов на область переднезадней или переднесептальной комиссур.
Наибольшее распространение получили методики шовной и полукружной анулопластики.
Шовная анулопластика заключается в бикуспидализации клапана путём наложения 1—2 широких П-образных швов с прокладками на фиброзное кольцо у основания задней створки с захватом прилегающих частей септальной и передней створок.
Метод полукружной анулопластики по Амосову (рисунок 29, а) и по Де Веге (рисунок 29, б) заключается в прошивании фиброзного кольца нитями в месте расположения передней и септальной створок. Концы нитей затем сближаются до полного совмещения створок и завязываются на прокладках.
Операции протезирования сердечных клапанов. Основным принципом хирургического лечения пороков сердца должно быть стремление сохранить клапан сердца больного. Протезирование клапана следует рассматривать как вынужденную операцию. Её выполнение может быть оправдано и необходимо только при строгих показаниях в рамках определённых форм деструкции клапана, при которых операции, сохраняющие клапан, невыполнимы.
Основными показаниями к протезированию клапанов сердца (смотри полный свод знаний) являются уменьшение запирательной площади мембран, их натяжение и акинезия вследствие укорочения подклапанных структур при их непосредственном спаянии со створками (что может иметь место при диафрагмоподобных и воронкообразных стенозах); сочетание этих форм фиброза с выраженным кальцинозом; травматические повреждения клапана.
Протезирование митрального клапана показано при митральной недостаточности и сочетанном митральном пороке с выраженной степенью желудочково-предсердной регургитации (II степень по классификации Б. В. Петровского), если имеются выраженный кальциноз клапана (II и III степень), его деформация, изменения подклапанных структур и другие препятствия для осуществления восстановительной операции.
Для замены митрального клапана используют протезы различной конструкции — низкопрофильные, в частности МКЧ-27 (полусферический) и МКЧ-59 (дисковый с откидным запирательным элементом и центральным кровотоком), а также биопротезы, использование которых показано, в первую очередь, в случаях, когда исключается проведение постоянной антикоагулянтной терапии после установки клапанного протеза, необходимое, если применяются иные протезы.
Техника операции на начальных этапах (подключение АИК, доступ к митральному клапану) такая же, как при открытой комиссуротомии (смотри полный свод знаний: выше). После отсасывания из полости левого предсердия крови и тромботических масс края разреза левого предсердия широко разводят сердечными крючками, и митральный клапан становится хорошо доступным осмотру (рисунок 30, а). Створки клапана скальпелем и ножницами иссекают вместе с хордами и папиллярными мышцами (рисунок 30, б, в). Шаблоном-измерителем определяют подходящий по размеру клапанный протез. На края фиброзного кольца накладывают 12—16 П-образных швов; концы нитей проводят через манжету клапанного протеза. Затем протез устанавливают в просвете фиброзного кольца и завязывают швы. Концы нитей отрезают (рисунок 30, г).
Полость левого желудочка и левого предсердия заполняют кровью. Рану левого предсердия ушивают двухрядным швом атравматической нитью. Снимают турникеты с полых вен. После восстановления естественной гемодинамики удаляют венозные катетеры и артериальную канюлю.
Рану грудной стенки ушивают обычным способом с оставлением дренажей в полости перикарда, переднем средостении и правой плевральной полости.
Протезирование аортального клапана является одним из наиболее адекватных методов коррекции аортальных пороков, так как у 28% больных с аортальными пороками имеется кальциноз клапана, препятствующий восстановительной операции, а закрытая комиссуротомия при аортальном стенозе в 50—60% случаев ведёт к прогрессирующей аортальной регургитации.
Наилучший и устойчивый эффект протезирование аортального клапана даёт у пациентов со II—III стадией гемодинамических нарушений (по классификации Г. И. Цукермана и М. Л. Семеновского, 1967), когда сохранены резервы сократительной функции миокарда. В V стадии заболевания оперативное лечение противопоказано.
Важное значение в исходе хирургического лечения аортального порока имеет адекватная защита миокарда во время операции. С этой целью применяют различные методы: аноксическую остановку сердца, прямую и раздельную коронарную перфузию, электрическую фибрилляцию желудочков, глубокую гипотермию (смотри полный свод знаний: Гипотермия искусственная) и их сочетание. Наиболее распространён метод локальной Холодовой кардиоплегии (смотри полный свод знаний) с фармакологических защитой миокарда, который, во-первых, позволяет предупредить развитие необратимых ишемических изменений миокарда при прекращении естественного коронарного кровотока; во-вторых, обеспечивает условия, облегчающие выполнение внутрисердечных манипуляций, и, наконец, представляет достаточный лимит времени, необходимый для выполнения радикальной и адекватной коррекции порока.
Техника операции. Доступ — продольная стернотомия. Перикард широко вскрывают с обнажением восходящей аорты. В условиях искусственного кровообращения и кардиоплегии аорту пережимают специальным зажимом. Вскрывают аорту поперечным разрезом (рисунок 31, а). Дистальный край раны аорты отводят вверх наложенным швом-держалкой. На комиссуры аортальных клапанов накладывают три шва. Аортальный клапан иссекают скальпелем и ножницами. Шаблоном-измерителем подбирают клапанный протез. Каждый сектор аортального клапана прошивают 3—5 П-образными или обвивными швами, концы которых проводят через манжету клапанного протеза. Протез ориентируют с помощью ранее наложенных швов на комиссуры (рисунок 31, б) и устанавливают в аортальном отверстии так, чтобы устья коронарных артерий были выше манжеты протеза. Разрез аорты ушивают двухрядным швом — П-образным и обвивным (рисунок 31, в). Перед последним швом снимают зажим с аорты и шов затягивают на струе крови. Заканчивают искусственное кровообращение и зашивают рану грудной стенки обычным способом.
Многоклапанное протезирование при комбинированных пороках сердца. Развитие хирургии многоклапанных пороков сердца стало возможным благодаря успехам, достигнутым при протезировании отдельных клапанов, а также усовершенствованию методики искусственного кровообращения. Первые сообщения об успешном одновременном многоклапанном протезировании были сделаны в 1964 год Число таких операций не превышает 3000, несмотря на относительно высокую частоту комбинированных Пороки сердца приобретённые (примерно у 30% больных, направленных на оперативное лечение).
Многоклапанное протезирование поставило ряд новых вопросов в проблеме оперативного лечения Пороки сердца приобретённые К наиболее важным из них относятся выбор оперативного доступа, удобного для коррекции одновременно нескольких клапанов; последовательность их протезирования; типовой подбор клапанных протезов; длительность искусственного кровообращения и кардиоплегия в условиях длительной перфузии. Решение этих вопросов осуществляется комплексно с участием различных специалистов.
Митрально аортальное протезирование составляет, по сводным данным, наибольшую часть операций многоклапанного протезирования.
Наиболее распространённый операционный доступ — срединная продольная стернотомия. Имплантацию протезов производят в следующей последовательности: в первую очередь заменяют митральный клапан, затем аортальный. Для замещения митрального и аортального клапанов используют протезы различной конструкции, в том числе биопротезы. Важно правильно подобрать размер протезов, особенно протеза митрального клапана, расположение которого на пути оттока крови из левого желудочка в аорту может при больших габаритах протеза послужить причиной ограничения сердечного выброса. Поэтому при подборе протеза в митральную позицию следует руководствоваться в большей степени не диаметром фиброзного кольца, а размерами полости левого желудочка. Предпочтительны малогабаритные низкопрофильные протезы митрального клапана с полусферическим или дискообразным запирающим элементом.
Митрально трикуспидальное протезирование становится актуальным в свете накопления данных, свидетельствующих о том, что под диагнозом относительной трикуспидальной недостаточности, сопутствующей митральному пороку, чаще, чем предполагали ранее, скрывается органическое поражение трикуспидального клапана или подклапанных структур, которое, естественно, не исчезает после коррекции только митрального порока. Изучение отдалённых результатов протезирования клапанов показало, что эффективность замены митрального клапана в значительной степени зависит от своевременной и радикальной коррекции трикуспидального порока.
Операционный доступ — продольная стернотомия. В первую очередь производят протезирование митрального клапана, вторым этапом — трикуспидального.
Выбор протеза представляет определённые трудности, так как многие из существующих моделей протезов слишком громоздки и инерционны для правых отделов сердца. Замена трикуспидального клапана шариковым протезом даёт значительный процент тромбоэмболических осложнений при недостаточной коррекции гемодинамики (остаются повышение давления в правом предсердии и удлинение периода изгнания контрастированной крови). Применение каркасных протезов, сформированных из широкой аутофасции бедра, показало отличный гемодинамический эффект в ближайшие сроки после операции; однако через 3— 5 месяцев после операции наблюдается ухудшение состояния, обусловленное рецидивом трикуспидальной недостаточности в связи с выраженной рубцовой деформацией и склерозом створок. Наиболее пригодными для коррекции трикуспидального порока являются малогабаритные клапанные протезы с центральным током крови, а также биопротезы.
Митрально-аортально-трикуспидальное протезирование, по мнению большинства кардиохирургов, не намного сложнее одномоментной замены митрального и аортального клапанов. Во время операции митрально-аортального протезирования производят ревизию трикуспидального клапана, в результате которой может возникнуть необходимость в устранении и трикуспидального порока путём протезирования, комиссуротомии или анулопластики.
Целесообразность многоклапанного протезирования неоспорима. Однако в связи с тяжестью состояния больных с комбинированными пороками сердца и большой травматичностью операций результаты их заметно уступают таковым при изолированной замене поражённых клапанов. Летальность оперированных больных остаётся все ещё высокой. Вместе с тем имеются основания считать многоклапанное протезирование перспективной операцией. По мере накопления опыта, дальнейшего совершенствования моделей клапанных протезов и техники операции, методики искусственного кровообращения, а также улучшения дооперационной подготовки и послеоперационного лечения больных операционная летальность и число осложнений будут, несомненно, снижаться.
Таблица. Основные диагностические признаки наиболее распространённых приобретённых пороков сердца

| ||
| ||

| ||
| ||

| ||
| ||
| ||
| ||
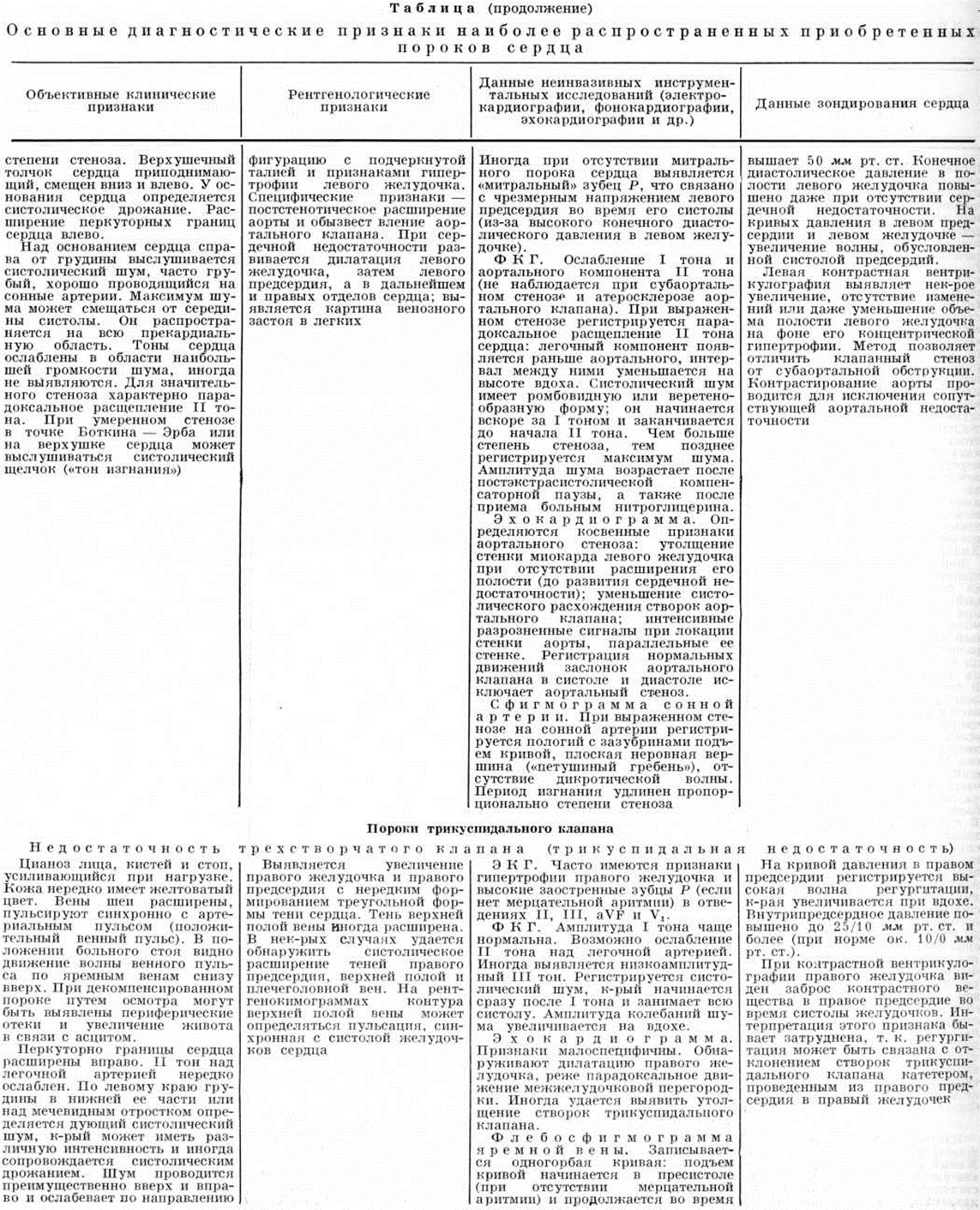
| ||
| ||
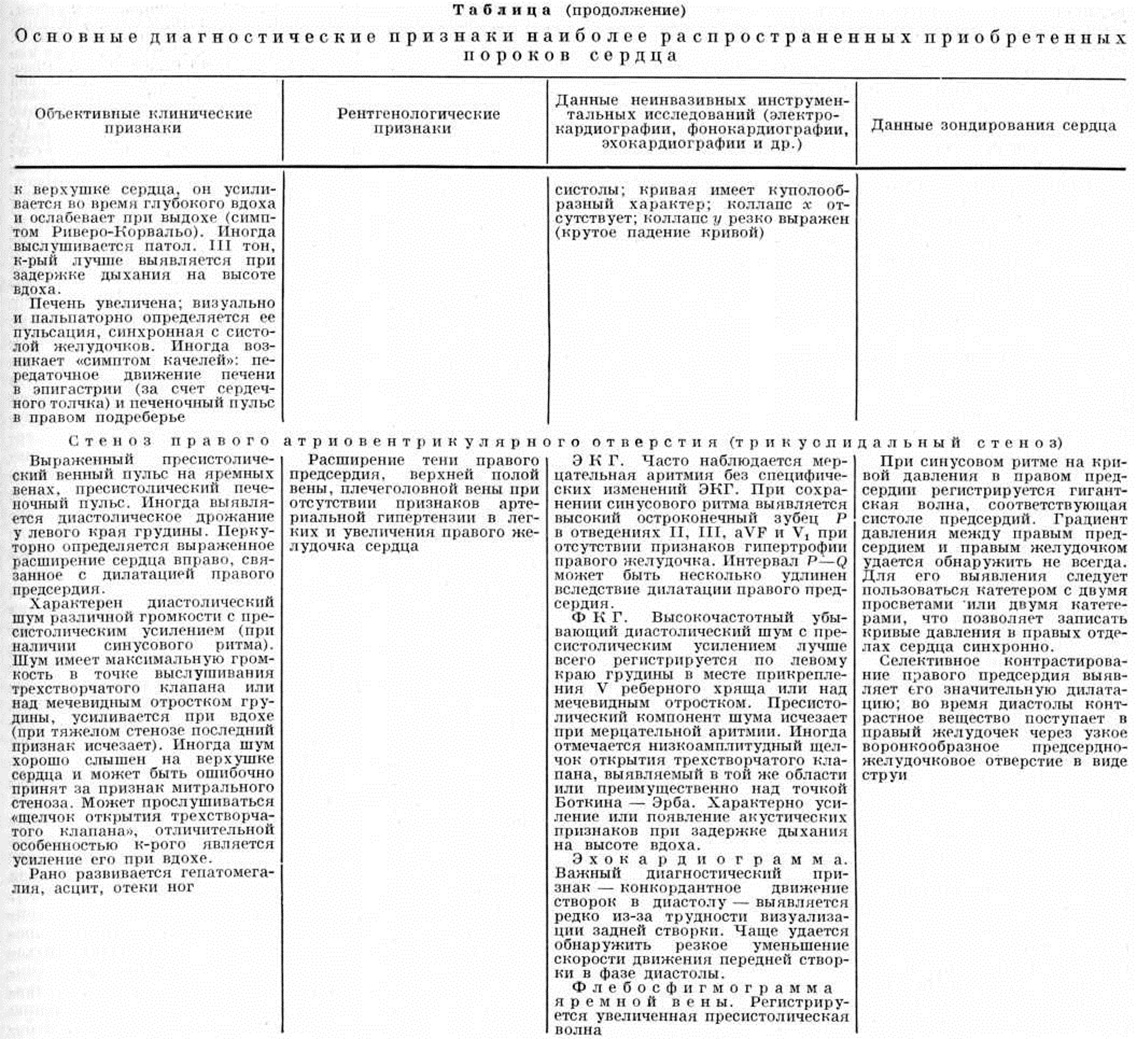
| ||
| ||
|
Богословский В.А.; Гогин E.E.; Жмуркин В.П.; Зубарев Р.П.; Малиновский Н.Н.; Соломатина О.Г.; Федорова Г.С.; Чекарева Г.А. |

|
⇐ Перейти на главную страницу сайта |
⇑ Вернуться в начало страницы ⇑ |
Библиотека Ordo Deus ⇒ |
⇐ Пороки сердца врождённые |
⇓ Полный свод знаний. Том первый А. ⇓ |
Пороховая болезнь ⇒ |
|
Все статьи в полном изложении, Вы можете найти в большой медицинской энциклопедии — Главный редактор: академик АН СССР (РАН) и АМН СССР (РАМН) Б.В. Петровский. — Москва издательство «Советская энциклопедия» 1989г. |
|
Внимание! Вы находитесь в библиотеке «Ordo Deus». Все книги в электронном варианте, содержащиеся в библиотеке «Ordo Deus», принадлежат их законным владельцам (авторам, переводчикам, издательствам). Все книги и статьи взяты из открытых источников и размещаются здесь только для чтения. |
|
Вся информация на сайте Ordo Deus находится в свободном доступе. Ordo Deus не предоставляет информацию на платной основе. |
|
Все авторские права сохраняются за правообладателями. Если Вы являетесь автором данного документа и хотите дополнить его или изменить, уточнить реквизиты автора, опубликовать другие документы или возможно вы не желаете, чтобы какой-то из ваших материалов находился в библиотеке, пожалуйста, свяжитесь с нами по e-mail: |
Вас категорически не устраивает перспектива безвозвратно исчезнуть из этого мира? Вы не желаете закончить свой жизненный путь в виде омерзительной гниющей органической массы пожираемой копошащимися в ней могильными червями? Вы желаете вернувшись в молодость прожить ещё одну жизнь? Начать всё заново? Исправить совершённые ошибки? Осуществить несбывшиеся мечты? Перейдите по ссылке: «главная страница».
|
© Ordo Deus, 2010. При копировании ссылка на сайт http://www.ordodeus.ru обязательна. |