Анемия |
||
 |
 |
Оглавление
|
АнемияАнемия (anaemia; греческое отрицательная приставка an- и haima— кровь; синоним малокровие) — состояние, характеризующееся уменьшением количества эритроцитов и снижением содержания гемоглобина в единице объема крови. При анемии в периферической крови нередко обнаруживаются и качественные изменения эритроцитов — их величины, формы и окраски. При некоторых анемиях в крови появляются ядерные предстадии эритроцитов (эритробласты, нормобласты, мегалобласты), незрелые формы эритроцитов (полихроматофилы), эритроциты, содержащие различные включения: цитоплазматические — сидероциты, базофильно- и аурофильно-пунктированные эритроциты и ядерные — хроматиновые пылинки, кольца Кебота, тельца Жолли (цветной рис. 1). Оглавление 1 — Компенсаторные механизмы при анемии 8 — Радиоизотопная диагностика От истинной анемии следует отличать гемодилюцию, то есть. разжижение крови за счет обильного притока тканевой жидкости, наблюдаемое, например, у больных в период схождения отеков, после операции с применением искусственного кровообращения. Подобная псевдоанемия проходит по мере того, как исчезает вызвавший ее «отек крови». Истинная анемия может маскироваться сгущением крови, напр. при обильной рвоте или профузных поносах; при этом вследствие уменьшения объема плазмы количество эритроцитов в единице объема крови может оказаться нормальным и даже повышенным. Характерной особенностью истинной анемии является либо абсолютное уменьшение массы эритроцитов — эритрона, либо функциональная недостаточность эритрона вследствие уменьшения содержания гемоглобина в каждом отдельном эритроците. При малокровии в организме нарушаются окислительные процессы и развивается гипоксия. На развитие гипоксии влияет не только степень малокровия, но и быстрота его развития, а также степень и быстрота адаптации организма к изменившимся условиям существования. Клиницист нередко наблюдает несоответствие между тяжестью малокровия и активным состоянием больного, что объясняется компенсаторными механизмами, обеспечивающими физиологическую потребность тканей в кислороде. Основная роль в компенсации анемического состояния принадлежит нервной и сердечно-сосудистой системам: гипоксия приводит к тому, что в кровь поступают недоокисленные продукты обмена веществ. Последние, воздействуя на центральную регуляцию кровообращения, а также на нервно-мышечный аппарат сердца, вызывают учащение сердечного ритма и ускорение кровотока, в результате чего минутный объем крови, выбрасываемой левым желудочком, увеличивается вдвое (до 8 л вместо 4 л в норме). Кроме того, при анемии развивается спазм периферических сосудов и в кровеносное русло поступают кровяные резервы из тканевых депо, главным образом из подкожной клетчатки. В более легких случаях анемии обеспечение тканей достаточным количеством кислорода достигается повышением физиологической активности эритроцитов и проницаемости капиллярной стенки для газов крови. Известное значение в компенсации гипоксии придают железосодержащим энзимам (цито-хромоксидаза, каталаза), являющимся потенциальными носителями кислорода, а также процессам бескислородного дыхания при участии глутатиона. |
 |
||
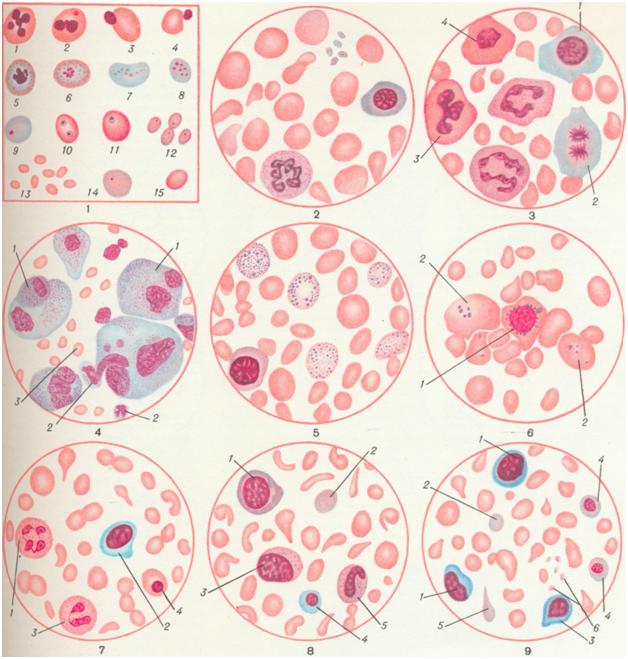
Различные формы эритроцитов крови при анемических состояниях: 1 и 2 — нормобласты в стадии кариорексиса; 3 и 4—энуклеация нормобластов путем выталкивания ядра; 5 — 9 — распад ядра с образованием телец Жолли в базофильно пунктированных эритроцитах (5 и 6) и полихроматофильных эритроцитах (7—9); 10 и 11 — тельца Жолли в ортохромных эритроцитах (после спленэктомии); 12 — хроматиновые пылинки в эритроцитах; 13 — микроциты; 14 — полихроматофильный эритроцит (макроцит); 15 — нормоцит. Рис. 2. Кровь при гиперхромной мегалоцитарной В12(фолиево) дефицитной анемии (анентеральная спруанемия). Анизопойкилоцитоз, гиперхромия, полихроматофилия эритроцитов. Рис. 3. Мегалобластическое кроветворение (стернальный пунктат) при анентеральной спруанемии). Мегалобласты: 1 — полихроматофильный; 2 — в стадии митоза; 3 — оксифильный с «трефовым» ядром; 4 — оксифильный с пикнотическим ядром. Рис. 4. Метастатические раковые клетки (1) в костномозговом пунктате; 2 — нейтрофилы; 3 — эритроциты. Рис. 5. Эритроциты с базофильной пунктацией. Рис. 6. Костный мозг при железо-рефрактерной (сидероахрестической) анемии: 1 грубозернистый кольцевидный сидеробласт; 2 — грубозернистые сидероциты. Рис. 7. Кровь ребенка при простой гипохромной алиментарной анемии: 1 и 3 — сегментоядерный нейтрофил; 2 —большой лимфоцит; 4 — ортохромный нормобласт. Пойкилоцитоз, анизоцитоз, олигохромемия. Рис. 8. Кровь ребенка при анемии Якша — Гайема: 1 — базофильный мегалобласт; 2 — полихроматофильный эритроцит; 3 — нейтрофильный миелоцит; 4 — полихроматофильный нормобласт; 5 — палочкоядерный нейтрофил. Пойкилоцитоз, анизоцитоз, олигохромемия. Рис. 9. Кровь ребенка при анемии на почве чрезмерного употребления козьего молока: 1 — лимфоцит; 2 — полихроматофильный эритроцит; 3 — базофильный нормобласт; 4 — полихроматофильный нормобласт; 5 — полихроматофильный пойкилоцит (эритроцит); 6 — кровяные пластинки. Пойкилоцитоз, анизоцитоз.
Важнейшая роль в устранении анемии и восстановлении нормального состава крови принадлежит костному мозгу, его эритропоэтической функции.
О состоянии эритропоэтической функции костного мозга судят по морфологической картине стернального пунктата (по методу М. И. Аринкина), в частности по количественному соотношению эритро- и лейко-бластических элементов; в нормальных условиях это соотношение составляет 1 : 3 или 1 : 4. При повышенной регенерации красной крови, когда костный мозг функционирует преимущественно в направлении эритропоэза, соотношение эритро: лейко изменяется в пользу эритробластов, достигая 1 : 1 или 2 : 1 и даже 3:1.
В зависимости от преобладания в стернальном пунктате того или иного вида эритробластов различают следующие типы эритропоэза: а) эритробластический, б) пронормобластический, в) нормобластический, г) мегалобластический.
Завершающим этапом эритропоэтической функции костного мозга является процесс поступления зрелых, безъядерных эритроцитов из костного мозга в циркулирующую кровь. Эта важнейшая элиминирующая функция костного мозга выявляется динамическим исследованием основных показателей красной крови — содержания гемоглобина, количества эритроцитов и процента ретикулоцитов.
Анемия возникает либо когда убыль эритроцитов в крови (вследствие кровопотери или кроворазрушения) на данном отрезке времени превышает максимальные возможности регенерации костного мозга, либо вследствие недостаточной эритропоэтической функции костного мозга. Последняя в свою очередь зависит либо от дефицита необходимых для нормального кроветворения веществ (железа, витамина В12, фолиевой кислоты — так называемые дефицитные анемии), либо от неусвоения (неиспользования) данных веществ костным мозгом (так называемой ахрестические анемии).
Патогенез некоторых анемий связан с генетическими особенностями: в одних случаях могут нарушаться энзимные структуры эритроцитов, что приводит к их повышенной чувствительности по отношению к различным внешним агентам (медикаментам, растительным продуктам) с последующим массивным внутри-сосудистым гемолизом; в других случаях под влиянием наследственных или приобретенных факторов нарушается синтез гема (смотри Гемоглобин), что приводит к состоянию ахрезии, то есть неиспользованию ряда метаболитов, в первую очередь железа и витаминов кроветворения (витаминов В12, В6, фолиевой кислоты).
Разработано множество классификаций анемии. В соответствии с морфологическим и функциональным состоянием костного мозга, его способностью к регенерации и компенсации анемического состояния различают следующие формы анемии: гиперрегенераторную, регенераторную (при острой кровопотере, гемолизе), гипорегенераторную (при хронической кровопотере), гипопластическую, апластическую (при панмиелофтизе), диспластическую или дизэритропоэтическую [при В12-(фолиево) дефицитных состояниях, врожденном многоядерном эритробластозе].
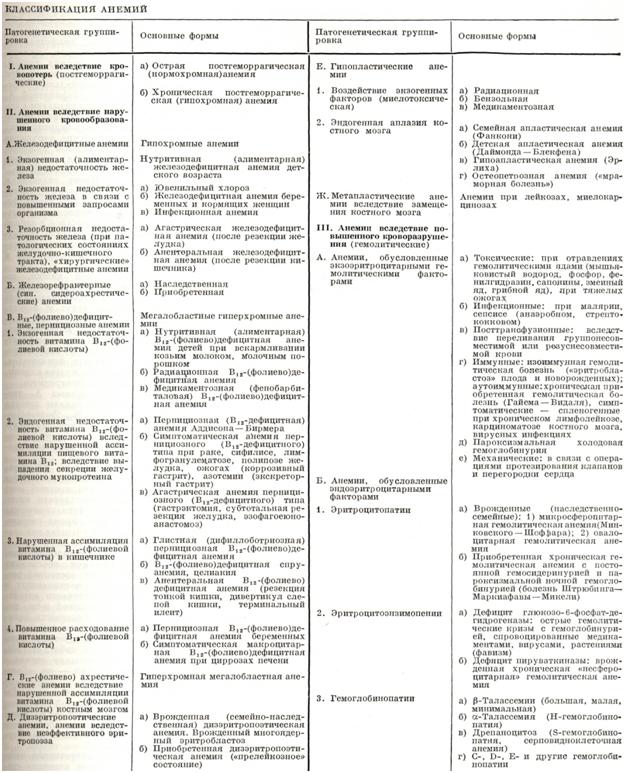
По классификации, предложенной Г. А. Алексеевым, различают три основные группы анемий: анемия вследствие кровопотерь — постгеморрагические; анемия вследствие нарушенного кровообразования; анемия вследствие повышенного кроворазрушения — гемолитические (смотри таблицу). Различают также острую и хроническую анемию.
 |
 |
 |
При анемии выявляется комплекс изменений, отражающих острую или хроническую недостаточность кровоснабжения. Характер изменений зависит от формы анемии, фазы развития и проводимой терапии. Макроскопически отмечается бледность и нередко желтушность кожи. При хронической анемии отмечается развитие подкожной жировой клетчатки, жировой ткани в брыжейке, сальнике и вокруг внутренних органов. Мышца сердца дряблая, тусклая, в области иапиллярных мышц может наблюдаться желтый крап. Печень на разрезе бледно-серого цвета, рисунок долек стерт. Селезенка часто уменьшена в размерах, капсула морщиниста, на разрезе пульпа дает соскоб. В толще жировой ткани брыжеек могут выявляться множественные мелкие (0,3—0,4 см в диаметре) лимфатические, узлы темно-красного цвета. Костный мозг плоских костей обычного вида, в средней и нижней трети бедра жировой, с участками кроветворения розово-красного цвета. Иногда костный мозг становится деятельным на всем протяжении бедра. Микроскопическое исследование выявляет жировую дистрофию в мышце сердца и в печени, а также отложение липидов в цитоплазме клеток эндотелия сосудов головного мозга, паренхиматозных органов. Обнаруживаемые в костном мозге изменения различны в зависимости от остроты и формы процесса и эффективности проведенного лечения. Гистологическое исследование биопсий костного мозга позволяет уточнить степень его поражения и способствует дифференциации с другими заболеваниями. Изучение биопсий костного мозга в динамике болезни позволяет установить эффективность терапии и активность процессов регенерации костного мозга.
Симптомы заболевания бывают более или менее выражены в зависимости от степени анемизации и адаптации больного. Обычно отмечается слабость, быстрая утомляемость, одышка и сердцебиение при физической нагрузке, бледность кожи и слизистых оболочек. При глубокой анемии, особенно при ее быстром развитии, возникают частые головокружения, шум в ушах, нарушение зрения в виде мелькания «мушек» перед глазами, снижение остроты зрения, иногда вплоть до полного амавроза в связи с нарушением питания зрительных нервов в результате гипоксии. При выслушивании сердца определяется «дующий» систолический шум у верхушки и на соустьях, возникающий в результате гидремии и компенсаторного ускорения кровотока.
Анемия агастрическая возникает обычно после полного удаления (гастрэктомии) или субтотальной резекции желудка. Частичная резекция, широко применяемая при язве желудка, как правило, не сопровождается анемией. Лишь у части больных (преимущественно у женщин) наблюдается железодефицитная анемия.
Агастрическая анемия бывает железодефицитная и В12-(фолиево) дефицитная; проявляется обычно в сроки от 3 до 5 лет после операции гастрэктомии, иногда раньше — через 1— 1½ года.
От классической пернициозной анемии Аддисона — Бирмера агастрическая В12-дефицитная анемия отличается меньшей выраженностью симптомов внутрикостномозгового гемолиза (на почве дизэритропоэза).
Лечение агастрической анемии проводится по тем же принципам, что и лечение пернициозной анемии при железодефицитной анемии.
Профилактика агастрической анемии заключается в своевременном (еще до развития явлений В12-недостаточности) назначении витамина В12 в инъекциях до 100 — 200 мкг 1—2 раза в месяц, начиная с первых месяцев после операции. Препараты железа применяют по показаниям (при гипохромии эритроцитов, сидеропении).
Анемия анкилостомная вызывается паразитическими червями из класса нематод — анкилостомами (смотри Анкилостомидозы). Гризингер (W. Griesinger, 1854) показал, что анкилостомы являются возбудителями так называемого египетского хлороза; «горная анемия», или анемия шахтеров, наблюдавшаяся как массовое заболевание землекопов, работавших при прокладывании Сен-Готардского туннеля, была также анкилостомного происхождения. Патогенез анкилостомной анемии связан с потерей крови. Она протекает по типу железодефицитной анемии с низким цветным показателем (0,4—0,6), микроцитозом и умеренным ретикулоцитозом. В тяжелых случаях количество гемоглобина падает до 2—3 г%. Картина белой крови характеризуется лейкопенией и высокой эозинофилией (до 74%). Диагноз ставят на основании обнаружения яиц анкилостом в фекалиях или дуоденальном содержимом; в последнем можно обнаружить и живые половозрелые особи. Важнейшим лечебным и профилактическим мероприятием является дегельминтизация, при выраженной анемии — после предварительного курса антианемического лечения большими дозами железа.
Анемия анентеральная.
Под этим названием объединяют различные формы анемии, связанные с нарушением всасывания в тонкой кишке белков, минералов и витаминов. Наиболее известны пернициозно-анемические состояния, возникающие при затяжных энтеритах, особенно при спру (так называемая пернициозная спру-анемия — цветной рис. 2 и 3). Пернициозоподобные анемии возникают нередко в связи с органическими поражениями кишечника (полипоз, злокачественные опухоли, ретикулосаркоматоз, лимфогранулематоз), при дивертикулах, стриктурах и обширных резекциях тонкой, особенно подвздошной, кишки, при региональных (терминальных) илеитах. Патогенез В12-дефицитной анемии в последних случаях связывают с выпадением функции кишечного белка-акцептора. В происхождении этих форм анемии имеет значение нарушение всасывания в пораженном кишечнике как железа, так и антианемических факторов — витамина В12, фолиевой кислоты. Имеет значение и дисбактериоз, в результате которого нарушаются процессы биосинтеза фолиевой кислоты молочнокислыми бактериями, а размножающаяся в тонкой кишке кишечная палочка конкурирует с макроорганизмом в использовании пищевого витамина В12 и фолиевой кислоты.
Поражения тонкой кишки, сопровождающиеся общей (белковой, минеральной и поливитаминной) недостаточностью, ведут к возникновению смешанной, В12-(фолиево) железодефицитной, анемии Известны также анентеральные железодефицитные анемии, протекающие по типу хлороза, с низким цветным показателем, низким содержанием железа плазмы, но с макроцитозом эритроцитов.
Лечение анентеральных анемий проводят по общим правилам лечения железо-, витамино В12-(фолиево) дефицитных анемий. Учитывая нарушение кишечной абсорбции, все антианемические препараты следует назначать парентерально.
Анемия ахрестическая (Израэльса — Уилкинсона болезнь) возникает вследствие того, что костный мозг не в состоянии использовать имеющиеся в организме антианемические субстанции. В наст, время рассматривается некоторыми учеными как эритромиелоз.
Анемия В12-(фолиево) дефицитная. Под этим названием объединяют группу анемических состояний различной этиологии, возникающих в результате недостаточности витамина В12 и (или) фолиевой кислоты, для которых характерно, в частности, повышение цветного показателя (1,2—1,8) и появление патологических форм эритроцитов (цветной рис. 2).Смотри Пернициозная анемия.
Анемия бензольная — смотри Гипопластическая анемия.
Анемия гемолитическая — смотри Гемолитическая анемия.
Анемия гипохромная — смотри Железодефицитная анемия.
Анемия гиперхромная — смотри Пернициозная анемия.
Анемия гипорегенераторная чаще всего возникает как конечная стадия хронической Постгеморрагической анемии, а также в связи с общей интоксикацией, кахексией и истощением необходимых для построения эритроцитов субстанций — железа, белков, витаминов, микроэлементов. Картина крови при гипорегенераторной анемии характеризуется нормо- или гипохромазией, редко гиперхромазией, с выраженными дегенеративными изменениями эритроцитов (авизо- или пойкилоцитоз) при нормальном или незначительно пониженном количестве лейкоцитов (гранул оцитов) и нормальном количество кровяных пластинок.
Отличие гипорегенераторной анемии от собственно гипопластической анемии заключается в следующем: 1) как правило, первичным моментом в развитии гипорегенераторной анемии является кровотечение, следовательно, патогенетически эта анемия — постгеморрагическая; 2) гипорегенераторная анемия никогда не переходит в полную аплазию; 3) костномозговое кроветворение больше соответствует состоянию гипорегенерации (а не гипоплазии); среди эритробластов преобладают базофильные формы; следовательно, имеется не аплазия родоначальных элементов эритропоэза, а истощение фондов железа, белков и витаминов, необходимых для построения зрелых форм красной крови; 4) данное состояние обратимо: длительное и систематическое комплексное лечение выводит костный мозг из торпидного состояния, наступает практическое выздоровление.
Анемия дизэритрогюэтическая — смотри Дизэритропоэтическая анемия.
Анемия дифиллоботриозная.
Этиологическая роль широкого лентеца в развитии анемии доказана излечением больных после изгнания паразита, на что впервые обратил внимание С. П. Боткин (1884). Исследование желудочного сока у лиц, инвазированных широким лентецом, показало нормальное содержание внутреннего антианемического фактора. Возникновение анемии связывают с нарушением усвоения или разрушением антианемических веществ (витамина В12, фолиевой кислоты). Картина крови в разгар болезни аналогична таковой при пернициозной анемии и отличается лишь выраженной эозинофилией (до 30—40%). Костномозговое кроветворение представляет картину мегалобластического эритропоэза. Лечение глистной анемии сводится к изгнанию паразита. При истинной дифиллоботриозной анемии после дегельминтизации больные быстро выздоравливают без специальной антианемической терапии. При тяжелом течении необходима предшествующая анти анемическая терапия (витамин В12), эффект которой проявляется еще до изгнания паразита. Профилактика заключается в предупреждении глистных инвазий.
Анемия железодефицитная — смотри Железодефицитная анемия
Анемия железорефрактерная (цветной рис. 6) — общее название для обширной группы анемических состояний, объединяемых по признаку высокого содержания железа в плазме и рефрактерности к лечению железом, подробнее — смотри Железорефрактерная анемия.
Анемия Ледерера — смотри Гемолитическая анемия.
Анемия медикаментозная — не столь частое явление, если принять во внимание современные масштабы применения химиотерапевтических средств и антибиотиков. В широком плане различают две группы лекарственных анемий.
К первой группе относят миелотоксические анемии, возникающие в связи с цитостатической (химио- или лучевой) терапией, проводимой по поводу опухолевого заболевания или системной патологии крови. Потенциально любое цитостатическое средство, обладающее миелодепрессивным действием, способно вызвать анемию гипопластического типа. Ко второй группе относят медикаментозные анемии, возникновение которых связано с индивидуально повышенной чувствительностью организма к определенным лекарственным веществам.
Большинство медикаментозных анемий рассматривают либо в плане антивитаминной активности препарата, либо в аспекте аутоиммунной агрессии, где лекарство играет роль гаптена (смотри Антигены), либо в аспекте индивидуальной неполноценности энзимных структур эритроцитов, обусловливающей «гемолитическую готовность» в связи с приемом некоторых медикаментов. При длительном применении массивных доз сульфаниламидов и некоторых антибиотиков (биомицина, хлорамфеникола, синтомицина, левомицетина) проявляется бактериостатическое действие данных препаратов на микробную флору тонкой кишки; в результате дисбактериоза нарушается биосинтез ряда витаминов, в частности фолиевой кислоты.
Представляют интерес В12-(фолиево) дефицитные анемии, спровоцированные приемом некоторых противомалярийных (дараприм) и противоэпилептических средств — дифенина (дифенилгидантоина, фенитоина), гексамидина (примидона), мезантоина, люминала (фенобарбитала) и других барбитуратов, а также фурадонина (нитрофурантоина) и бутадиона (фенилбутазона). Патогенетическая связь анемии с антифолиевой активностью данных препаратов доказывается понижением концентрации фолиевой кислоты в крови лиц, принимавших их, и положительным эффектом лечения фолиевой кислотой (в дозах 50 — 100 мг в день). Менее эффективно лечение витамином В12.
В12-(фолиево) дефицитная анемия медикаментозного генеза сопровождается признаками недостаточности витаминов группы В, в частности фолиевой и никотиновой кислот (глоссит, гиперкератоз, понос, изменения психики), чаще развивается у слабых, истощенных больных.
От классической пернициозной анемии Аддисона — Бирмера медикаментозная В12-(фолиево) дефицитная анемия. отличается сохранностью желудочной секреции, нормальной концентрацией витамина В12 в крови (при нормальной абсорбции меченного по кобальту витамина В12 в кишечнике) и отсутствием неврологических симптомов.
Имеются описания анемии, возникающей в связи с приемом противотуберкулезных препаратов. Патогенез этой анемии сложный; есть основания рассматривать ее как железорефрактерную анемию, обусловленную нарушением синтеза гема в связи с расстройством обмена витамина В6 (пиридоксинпиридоксальфосфата).
Лечение медикаментозных анемий заключается в прекращении приема препарата, вызвавшего анемию, и введении фолиевой кислоты.
Анемия медикаментозная гемолитическая (энзимодефицитная) — смотри Энзимопеническая анемия.
Анемия миелотоксическая — анемия вследствие токсического угнетения костного мозга при различных экзогенных (бензол) и эндогенных (при поражении почек, печени) интоксикациях (смотри Гипопластическая анемия).
Анемия мишеневидноклеточная — смотри Талассемия.
Анемия пернициозная — смотри Пернициозная анемия.
Анемия при почечной недостаточности в большинстве случаев носит гипохромный характер,свойственный железодефицитной анемии. У некоторых больных развивается гииерхромная пернициозоподобная анемия. Отмечается нейтрофильный лейкоцитоз (с сохранением эозинофилов), при уремии до 12 000—20 000 в 1 мкл. Известную роль в развитии анемии при почечной недостаточности играет поражение желудочно-кишечного тракта. В свете данных об эритропоэтинах высказывается мнение, что причиной анемии при почечной недостаточности является нарушение функции юкстагломерулярного аппарата почек. Согласно другим авторам, установившим тормозящее влияние сыворотки крови почечных больных на пролиферативную активность эритробластов костного мозга, анемии. при почечной недостаточности возникает под влиянием накопления в крови ингибиторов эритропоэтина. Инактивация ингибиторов эритропоэтина связана с неизвестной еще функцией почек.
Лечение — витаминотерапия, переливание эритроцитной массы. В перспективе — разработка получения эритропоэтинов.
Анемия при поражениях печени.
При хронических диффузных поражениях печени (гепатиты), независимо от этиологии процесса, возникает макроцитарная анемия нормохромного или умеренно гиперхромного типа, что связано с нарушением депонирования и утилизации витамина В12, а также фолиевой кислоты. При подострой дистрофии печени макроцитарная анемия гиперхромного типа является одним из важнейших показателей тяжелого нарушения функции печени и имеет серьезное прогностическое значение.
Развитие тяжелой пернициозоподобной анемии при метастатическом раке печени может служить указанием на первичную локализацию рака в желудке.
При хронически активных (так называемых люпоидных) гепатитах, циррозах печени, развивающихся по аутоагрессивному механизму, нередко возникает гемолитическая анемия, протекающая по типу приобретенного аутоиммунного гемолиза, с положительной прямой пробой Кумбса (смотри Кумбса реакция).
Анемия при метастазах рака в костный мозг чаще всего развивается при раке предстательной, молочной, щитовидной желез, раке легких, гипернефроме. При метастазировании злокачественной опухоли в костный мозг (миелокарциноз) синдром анемии занимает ведущее место в клинической картине заболевания. Исходный очаг процесса (опухоль, давшая метастаз рака в кость) нередко настолько мал, что никакими методами исследования не выявляется. Отличительными особенностями этой анемии являются необычайно выраженный эритронормобластоз и лейкемоидная картина крови. Однако в трети случаев, даже при очень значительном распространении метастазов по костям, лейкемоидная реакция может не наблюдаться. Картина крови зависит не только от механического фактора — имплантации в костный мозг раковых клеток, но и от реактивности костного мозга. Между типом опухоли и характером реакции костного мозга не существует видимой связи.
Стернальная пункция дает возможность диагностировать метастазы в костный мозг даже при отсутствии клинических данных (цветной рис. 4). Цитологическая диагностика не представляет особых трудностей; наиболее важным признаком раковых клеток является их атипия по сравнению с окружающей миелоидной тканью. Наряду с атипическими, не свойственными костному мозгу клетками, в костномозговом пунктате встречаются неопластические клетки, которые в условиях среды костного мозга подвергаются своеобразной метаплазии, приобретая некоторые свойства миелоидных элементов, в частности азурофильную зернистость. При диффузной метаплазии костного мозга инородной тканью картина крови может приближаться к той, какая наблюдается при хроническом миелолейкозе или остром миелобластном лейкозе.
Анемия свинцовая развивается под влиянием интоксикации организма свинцом или его соединениями. В настоящее, время рассматривается как прототип анемии, связанной с нарушением синтеза гема.
Римингтон (Rimington, 1938) впервые высказал мнение о том, что свинец препятствует вхождению железа в порфириновое кольцо и тем самым нарушает формирование гема из про-топорфирина и железа. Современные исследователи обнаружили в моче больных свинцовой анемии значительное содержание 6-аминолевулиновой кислоты (6-АЛК). Свинец, блокируя ферментные системы, участвующие в синтезе порфиринов, тормозит синтез гема и на более ранней стадии — образование из 6-АЛК порфобилиногена. Как полагают, основная сущность токсического действия свинца заключается в блокировании сульфгидрильных групп ферментов. Непосредственную роль в нарушении синтеза гема играет подавление активности следующих ферментных систем: дегидразы 6-АЛК, декарбоксилазы уропорфириногена, гемсинтетазы. Следствием (не причиной!) неполноценного кроветворения является укорочение жизненного цикла эритроцитов и ускоренный эритролиз, сопровождающийся симптомами квазигемолитической желтухи (гипербилирубинемия, уробилинурия, повышенное содержание стеркобилина в кале).
Клиническая картина свинцовой интоксикации многообразна: симптомы поражения желудочно-кишечного тракта, нервной и сердечно-сосудистой систем, кроветворных органов. Уже в начальной стадии и при легкой степени свинцовой интоксикации картина крови (цветнной рис. 5) обнаруживает характерные изменения в виде значительного ретикулоцитоза и базофильной пунктации эритроцитов. При более выраженной интоксикации развивается анемия обычно гипохромного типа, со снижением гемоглобина в тяжелых случаях до 8—6 г%. Наряду с выраженной гипохромией эритроцитов отмечается высокое содержание железа в сыворотке. Костномозговой пунктат характеризуется выраженной эритронормобластической реакцией и сидеробластозом с преобладанием кольцевидных форм.
Диагноз свинцовой интоксикации ставят на основании анамнеза, характерной картины крови (базофильная пунктация эритроцитов и гиперретикулоцитоз, неадекватные степени анемии и гемолиза); окончательно подтверждается обнаружением в моче свинца; особенно большие количества свинца (до 2 мг на 1 л мочи) выделяются после введения комплексона. Известное диагностическое значение, особенно на ранней стадии свинцовой интоксикации, может иметь обнаружение в моче 6-аминолевулиновой кислоты, являющейся наиболее ранним биохимическим признаком нарушенного синтеза гема.
Для лечения в качестве специфического антидота применяют комплексон — динатрийкальциевую соль этилендиаминтетрауксусной кислоты (тетацин-кальций), образующую со свинцом прочный комплекс, легко удаляемый из организма. Препарат вводят в вену в виде 10% раствора по 20 мл ежедневно в течение 5 дней. Обычно проводят 3—4 курса с 4— 5-дневными интервалами. Применяют и другие комплексоны: комплецин — внутрь в таблетках (по 2 г через день в течение 20 дней) или в вену (в виде 10% раствора по 20 мл в день в течение 5 дней), Д-пеницилламин (в вену в разовой дозе 1 г).
Разработанная в СССР система диспансерного наблюдения за работниками производств, связанных с добычей, выплавкой или применением свинца, способствует своевременному выявлению легких форм и предупреждению тяжелых форм свинцовой интоксикации.
Анемия сериовидноклеточная — смотри Серповидноклеточная анемия.
Анемия спленогенная рассматривается в наст, время как первая стадия системного заболевания селезенки, печени и костного мозга, так называемый миело-гепато-лиентального синдрома, или Банти синдрома. Картина периферической крови характеризуется панцитопенией, то есть количественным уменьшением всех клеточных форм. При этом собственно анемия, то есть эритроцитопения, не столь выражена; нередко на первый план выступает лейкопения (так называемая селезеночная гиполейкия) или тромбоцитопения, которой иногда сопутствует геморрагический диатез (смотри Пурпура тромбоцитопеническая). От собственно спленогенной анемии следует отличать анемию, развивающуюся вследствие желудочно-кишечных кровотечений на почве тромбоза селезеночной вены у больных с тромбофлебитической спленомегалией. При спленогенной анемии показана операция удаления селезенки, однако показания к операции должны рассматриваться индивидуально.
Анемия сфероцитарная — смотри Гемолитическая анемия.
Анемия тиреопривная развивается на почве гипотиреоза. Различают три вида тиреопривной анемии: нормохромную, гипохромную, гиперхромную (пернициозоподобную). Полагают, что дефицит тироксина приводит к расстройству утилизации специфических факторов кроветворения (железа, фолиевой кислоты, витамина В12).
Анемию при зобе Хасимото (смотри Хасимото болезнь) рассматривают в настоящее время в аспекте аутоиммунного конфликта. В этой связи сочетание гипотиреоза с пернициозной (В12-дефицитной) анемии может быть истолковано как результат органоспецифической иммунизации, что доказывается обнаружением антител направленного действия как против клеток щитовидной железы (тирео-глобулина), так и против париетальных клеток фундальных желез (внутреннего фактора Касла).
При анемии, протекающей на фоне гипотиреоза, наилучший лечебный эффект достигается применением железа и цианокобаламиыа (витамина В12 В обычной дозировке) в сочетании с тиреоидином (0,1—0,2 г 3 раза в день).
В раннем возрасте анемии наблюдается очень часто, что объясняется функциональной лабильностью кроветворного аппарата ребенка. Даже незначительные и недлительные погрешности в питании, неблагоприятные условия быта, недостаточное использование свежего воздуха и дневного света, случайные заболевания и так далее легко вызывают анемию, причем большое значение имеют индивидуальные особенности ребенка; велика роль наследственности. Нарушенный гемопоэз у детей, особенно в первые годы жизни, приобретает черты эмбрионального типа со склонностью к развитию лейкемоидных реакций. Вместе с тем при устранении причины, вызвавшей анемию, отмечается выраженная способность кроветворного аппарата к регенерации и восстановлению нормального состава крови.
Алиментарная анемия обычно наблюдается у детей 6 —18 месяцев, получающих однообразную молочную или мучную пищу (цветной рис. 7).
По клинической картине различают формы легкие, когда общее состояние ребенка почти не нарушено, средней тяжести и тяжелые. При анемии средней тяжести отмечается общая пастозность, бледность кожи и слизистых оболочек, увеличение живота, умеренная гиперплазия лимфатических, узлов и миндалин, запоры. Количество гемоглобина понижается до 8—10 г%, число эритроцитов — до 4 000 000, редко до 3 000 000, цветной показатель 0,5— 0,7; полихроматофилия, умеренный ретикулоцитоз, единичные нормобласты; число лейкоцитов, лейкоцитарная формула, тромбоциты — в пределах нормы. Сочетание алиментарного фактора с инфекцией значительно ухудшает течение анемии.
Тяжелая форма анемии (алиментарно-инфекционная, анемия Якша — Гайема; цветной рис. 8) в наст, время почти не встречается. Общее состояние ребенка тяжелое, слизистые оболочки очень бледны, кожа восковидного или желтоватого цвета с кровоизлияниями, почти всегда наблюдается тяжелый рахит, печень и селезенка сильно увеличены; количество гемоглобина и число эритроцитов резко снижены, число лейкоцитов достигает 15—20 тысяч, иногда больше, в лейкоцитарной формуле преобладают лимфоциты или нейтрофилы, много ядерных форм эритроцитов и незрелых форм нейтрофильных лейкоцитов.
Иногда алиментарная анемия по общей клинической и гематологической картине (цветной рис. 9) сближается с пернициозной; описывают ее под названием псевдопернициозной или алиментарной (нутритивной) мегалобластической анемии, которая развивается на почве однообразного вскармливания козьим молоком или сухими молочными смесями. В патогенезе — недостаточное количество в пище фолиевой кислоты и витамина В12; имеет значение и дефицит витамина С, принимающего участие в образовании из фолиевой кислоты тетрагидро-фолиевой; недостаточная продукция гастромукопротеина, нарушение кислотно-щелочного равновесия, аутоинтоксикация в результате усиленных процессов гниения в кишечнике. Дети беспокойны, плохо едят, прибавка в весе недостаточна, слизистые оболочки бледны, кожа с сероватым оттенком; печень и селезенка увеличены. А. нормо-, иногда гиперхромного, реже гипохромного характера.
Число эритроцитов может уменьшаться до 1 000 000 и ниже, анизоцитоз, пойкилоцитоз, ядерные формы эритроцитов, ретикулоцитов мало, базофильная зернистость в эритроцитах, реже — единичные мегалобласты, тельца Жолли, кольца Кебота. Число лейкоцитов несколько снижено или в пределах нормы, наклонность к гиперсегментации нейтрофильных лейкоцитов; число тромбоцитов снижено, нередко снижен также уровень железа сыворотки; в картине миелограммы — усиленный мегалобластический эритропоэз.
Такой же характер анемии бывает при целиакии и других заболеваниях кишечника, когда нарушаются процессы всасывания; относительно часто болеют недоношенные дети.
В лечении главное — рациональное питание с достаточным содержанием белков, витаминов, железа. Показаны препараты с аскорбиновой кислотой, способствующей стабилизации легко усвояемого двухвалентного железа, и 1—2% раствором разведенной соляной кислоты, необходимой для ассимиляции пищевого железа. Восстановленное железо дают по 0,1—0,3 г 3—4 раза в день; соли двухвалентного железа (глюконат и аскорбинат железа) — по 0,2 — 0,5 г 2—3 раза в день, они не уступают по эффективности восстановленному железу и не вызывают у детей диспептических явлений. При затруднениях в приеме порошков и таблеток можно назначать 10% водный раствор лимонно-аммиачного железа по 1 чайной ложке 2—3 раза в день. Хорошее действие оказывает гемостимулин, который применяют по 0,25— 0,5 г 3 раза в день. Препараты железа целесообразно назначать в промежутках между приемами пищи. Перед и сразу после приема железа не рекомендуется давать чай, жирные и мучные продукты во избежание образования нерастворимых соединений. При упорных анемиях более эффективно комбинированное лечение препаратами железа и витамина В12 по 50—100 мкг через день, 10 —15 инъекций. При непереносимости приема препаратов перорально и нарушении всасывания может быть применен ферковен по 1—2 мл внутривенно только в стационарных условиях. В резистентных случаях применяют трансфузию эритроцитной массы по 30—75 мл ежедневно 5—7 дней.
Анемия Фанкони — врожденная семейная панцитопения, отчетливо выявляющаяся чаще всего в возрасте 5—7 лет,— смотри Гипопластическая анемия.
Семейная гипопластическая анемия Эстрена — Дамешека — смотри Гипопластическая анемия.
Анемия Даймонда — Блекфана — смотри Гипопластическая анемия.
Пернициозная анемия типа Аддисона — Бирмера у детей наблюдается крайне редко — смотри Пернициозная анемия.
В последнее время описано несколько редких форм пернициозоподобных анемий, в том числе болезнь Имерслунд (О. Imerslund) — семейная В12-дефицитная анемия с сохраненным внутренним фактором Касла и протеинурией, и ювенильная В12-дефицитная анемия — следствие функциональной недостаточности желез желудка, вырабатывающих гландулярный мукопротеин при нормальном морфологическом состоянии слизистой оболочки желудка и сохраненной секреции соляной кислоты.
Наследственная мегалобластическая анемия (нарушение метаболизма пиримидинов, в частности оротовой кислоты) описана у двух детей трех месячного возраста; наследуется, по-видимому, по аутосомно-рецессивному типу. Эта форма анемии имеет пернициозоподобный характер с выраженным анизопойкилоцитозом и анизохромией; эритробласты, тельца Жолли, кольца Кебота; нейтропения, умеренная тромбоцитопения; в костном мозге — мегалобластический эритропоэз, сужение гранулоцитарного ростка при наличии гигантских миело- и метамиелоцитов. Оротацидурия. Задержка физического развития. С лечебной целью назначают уридин.
От истинной анемии надо отличать кажущуюся, или мнимую, анемию. Дети — практически здоровы и обычно жалоб нет; в периферической крови нормальное содержание гемоглобина и эритроцитов. Бледность кожи у таких детей объясняется особенностями расположения и кровенаполнения кожных капилляров, иногда несколько пониженным артериальным давлением. Эти дети требуют только тщательного соблюдения режима, соответствующего их возрасту.
Беременность — особое физиологическое состояние, сопровождающееся глубокой перестройкой всех видов обмена, которая, однако, не обусловливает развития особых форм анемии, присущих лишь беременным женщинам. Беременность здоровой до этого женщины, по-видимому, не часто провоцирует развитие анемии. Чаще беременность выявляет латентно протекавший патологический процесс или усугубляет течение существовавшего ранее заболевания. У беременных встречаются обычные клинические формы анемии, которые распространены среди населения вообще.
Следует отличать от истинной анемии у беременных иногда сопутствующее беременности состояние гемодилюции — разжижение крови непропорционально возрастающим объемом плазмы, неправильно называемое «псевдоанемией» или «физиологической анемией» беременных. Эдейер (F. L. Adair) и соавторы подсчитали, что объем крови у здоровых женщин за время беременности увеличивается в среднем на 23% (плазмы — на 25%, массы эритроцитов — на 20%). На 16-й нед. беременности обнаруживается нарастающая тенденция к снижению количества эритроцитов и гемоглобина. К 32-й неделе содержание гемоглобина в периферической крови уменьшается на 15% от исходной величины. Показатели допустимой нижней границы гемодилюции: гематокрит — 33/67—30/70, гемоглобин — 11 г% и число эритроцитов — 3 600 000. Гемодилюция клинически не проявляется, причины ее развития не ясны. Определенное значение имеет, вероятно, усиление секреции кортикостероидов, которые, несомненно, участвуют в мобилизации жидкости из внутри- и внеклеточных пространств в кровь [М. Г. Колпаков; Блумстедт (Blomstedt)]. Гемодилюция не свойственна здоровым женщинам с неосложненным течением беременности [Хюттен, Пейнтин, Бает, Лунд, Сиссон (Hytten и Paintin; Bast; Lund и Sisson].
Железодефицитная анемия занимает первое место среди анемий у беременных. Она обнаруживается у 15—30% беременных, что составляет 75—95% среди больных анемией беременных.
По статистике ВОЗ, железодефицитная анемия выявляется у 21 — 80% беременных при исследовании только гемоглобина и у 40—99% при применении более точного диагностического теста — насыщения трансферина. Ведущим фактором в патогенезе является недостаток железа, чаще утилизационного характера. При беременности организму женщины дополнительно требуется 900— 1100 мг железа, причем на нужды плода и построение плаценты расходуется от 375 до 500 мг (ВОЗ; Бает). Чем меньше железа поступает в организм беременной извне или резорбируется из желудочно-кишечного тракта, тем быстрее развивается дефицит. В подобных случаях расходуется депонированное железо. Истощению резервов железа способствуют частые роды, продолжительная лактация, длительные нарушения режима питания, паразитарные заболевания. Несомненно и значение дефицита витамина D, А, С, комплекса В. Угнетению эритропоэза способствует также избыток стероидов, особенно эстрадиола-17β и эстрона.
Беременных с гемоглобином ниже 11 г%, цветным показателем ниже 0,8, числом эритроцитов менее 3 600 000, гематокритом менее 33/67 и содержанием сывороточного железа ниже 60 мкг% рассматривают как больных железодефицитной анемией (ВОЗ). Клиника железодефицитной анемии у беременных проявляется обычными симптомами для этой формы анемии (смотри Железодефицитная анемия). Значительную опасность представляют осложнения беременности на фоне анемии, особенно поздние токсикозы и преждевременная отслойка нормально расположенной плаценты. Полная отслойка плаценты наблюдается в 2,9% случаев, преждевременные роды — в 11,3%, перинатальная детская смертность — от 4,5 до 20,7%. Пернициозоподобная, B12 -(фолиево) дефицитная анемия беременных учащается в декабре — апреле. Средний возраст больных 28—30 лет, преобладают повторнородящие. Заболевание начинается преимущественно во второй половине беременности, реже — в послеродовом периоде. После родов обычно наступает выздоровление, но возможны обострения при последующих беременностях. Заболевание начинается медленно. Иногда присоединяются расстройства желудочно-кишечного тракта. Отеки, гипертензпя и протеинурия часто маскируют истинную природу болезни. В отличие от пернициозной анемии, тяжелых поражений нервной системы не наблюдается, иногда отмечаются парестезии. Прогноз неблагоприятный как для матери (летальность 4%), так и для плода; преждевременные роды составляют 36%, мертворождаемость— 12% [Гузен (С. J. G. Goosen)].
Дифференциальная диагности ка между тяжелой формой железодефицитной и мегалобластной анемией основывается на совокупности клинических признаков, картине периферической крови и пунктата костного мозга.
Лечение анемии у беременных зависит от характера анемии. При дефиците железа рекомендуется одновременно назначать препараты, содержащие железо, медь и кобальт (феррокаль, ферробион, ферратол, гемостимулин, ферро-гематоген, ферковен). При В12-(фолиево) дефицитных анемиях — витамин В12 и фолиевую кислоту.
Следует учитывать и интересы плода, развивающегося в условиях хронической гипоксии, нарастающего авитаминоза и метаболического ацидоза. Поэтому витамины следует вводить в максимальных дозах, проводить оксигенотерапию и коррекцию кислотно-щелочного равновесия крови. По показаниям — переливания крови. Вопрос о сохранении беременности при анемии необходимо решать терапевту и акушеру совместно.
С помощью радиоактивных изотопов можно определить истинную или ложную анемию, синтез гемоглобина, величину эритропоэза, скорость и места преимущественного разрушения эритроцитов.
Основные методики и препараты: определение объема циркулирующих эритроцитов проводится с помощью Сг51, исследование продолжительности жизни эритроцитов — с Сг51 или Р32 (диизопропилфлюорофосфонатом), места преимущественного разрушения эритроцитов — с Сг51, наличия и величины скрытых кровотечений — с Сг51, интенсивности эритропоэза — с Сг51 или Fe59, всасывания железа — с Fe59 и всасывании витамина В12 — с Со58 (смотри Всасывание, радиоизотопное исследование).
Большинство тестов проводят in vivo; синтез гемоглобина изучают in vitro.
 |
 | |
Рис. 1. | ||
 |
 | |
Рис. 2. | ||
Индикаторные количества препаратов в зависимости от пробы колеблются от 1—5 мккюри Сг51, Со58, Fe59 до 200 мккюри Сг51. Измерительная аппаратура: счетчики сцинтилляционные жидкостные, а также с цельным и колодезным кристаллами, сканеры и гамма-камеры. Показатели нормы для большинства методов имеют относительное значение, так как зависят от деталей применяемых методик.
Информативность радиоизотопных методов больше, чем неизотопных.
В отличие от ранее распространенного метода дифференциальной агглютинации, при котором определяется продолжительность жизни только донорских (перелитых) эритроцитов, радиоизотопный метод позволяет определить продолжительность жизни и эритроцитов реципиента. В клинической практике единственным методом, позволяющим определить массу депонированных эритроцитов, является изотопный метод. Радиоизотопный метод более чувствителен, чем неизотопные методы выявления желудочно-кишечныъ кровотечений. Он дает возможность количественно определить величину кровопотери на протяжении достаточно долгого времени, что важно в оценке кровопотери как фактора, вызывающего постгеморрагическую анемию (смотри Желудочно-кишечное кровотечение, радиоизотопная диагностика).
Особенно целесообразно применение радиоизотопных тестов при затруднениях в диагностике таких анемий, как железо- и В12-дефицитные, железорефрактерные, Маркиафавы — Микели (рис. 1), апластическая. Диагноз аталассемии можно поставить только с помощью радиоизотопного метода. На рис. 2 показано, что в норме включение С14-аспарагиновой кислоты в α- и β-цепи глобина почти одинаково. При β-талассемии уменьшено включение С14-аспарагиновой кислоты в β-цепи, при α-талассемии — в α-цепи.
Радиоизотопное определение степени разрушения эритроцитов в селезенке при гемолитической анемии помогает установить показания к спленэктомии.
Смотри также Кровь, радиоизотопные исследования, Эритроциты, радиоизотопные исследования.
С целью изучения механизма возникновения анемия, процессов регенерации крови, выявления недостаточности кроветворной системы и разработки методов терапии искусственно воспроизводится малокровие у животных.
Экспериментальную анемию можно вызвать кровопусканием, разрушением эритроцитов гемолитическими ядами, нарушением целостности различных структурных образований нервной системы, удалением органов и другим.
Постгеморрагическую анемию вызывают кровопусканием, котрое делают однократно в количестве 30—40% объема циркулирующей крови (28—35 мл/кг) или повторно 10 — 15 раз по 10—12%; у кошек можно удалить 40—50% объема крови, у крыс и кроликов — не более 30%. Потеря 60—70% крови смертельна.
Массивное кровопускание вызывает у собак торможение функции коры больших полушарий в течение 7 — 8 дней, изменение сосудистых и дыхательных рефлексов, понижение артериального давления, гипоксемию и кислородное голодание. Объем крови уменьшается лишь в самом начале кровопотери, затем восстанавливается за счет жидкости, поступающей из тканей. Снижается гемоглобин, число эритроцитов, содержание белков плазмы. Сыворотка животных в течение 5—7 дней приобретает гемолитические свойства: происходит разрушение части эритроцитов и дальнейшее снижение количества эритроцитов и гемоглобина. Эти изменения тем более выражены, чем массивнее кровопускание. Продукты распада эритроцитов способствуют усилению выработки эритропоэтина, стимулирующего эритропоэз. Количество лейкоцитов в течение 4—8 дней увеличивается в основном за счет нейтро-фильных со сдвигом влево до юных. Число ретикулоцитов начинает увеличиваться уже через несколько часов и достигает максимальной величины на 5—6-й день, затем постепенно уменьшается. Число тромбоцитов вначале несколько снижается, но быстро восстанавливается и превышает исходный уровень в течение нескольких дней. Эритропоэтическая активность костного мозга усиливается без качественных нарушений кроветворения.
Характер и течение анемия зависят от величины кровопотери и регенераторной способности кроветворной ткани.
При многократных кровопусканиях усиление кроветворения может смениться угнетением в связи с истощением кроветворной ткани. После потери 40% объема крови восстановление показателей периферической крови наступает через 20—25 дней.
При повторных кровопотерях восстановление содержания гемоглобина отстает от восстановления количества эритроцитов в связи с истощением запаса железа; соответственно снижается цветной показатель; наблюдается анизо-, пойкилоцитоз, полихромазия эритроцитов, появляются нормобласты в периферической крови. При истощении кроветворной ткани снижается число ретикулоцитов и лейкоцитов. Сроки регенерации зависят от исходного функционального состояния организма и регенераторной способности кроветворной ткани, пола, питания, сезонных колебаний, условий содержания животных в виварии и другого.
Гемолитическая анемия вызывается чаще всего введением фенилгидразина, который разрушает старые эритроциты. В то же время продукты распада эритроцитов стимулируют эритропоэз; поэтому восстановление показателей периферической крови происходит быстрее, чем при постгеморрагической анемии.
2—5% водный раствор фенил гидразина вводят собакам и кроликам под кожу или внутримышечно 4—12 раз с промежутками в 2—3 дня или ежедневно из расчета 0,02—0,04 мг/кг на инъекцию; крысам и мышам вводят однократно внутрибрюшинно из расчета 2—8 мг на 100 г веса.
Степень и быстрота развития анемии зависят от дозы фенилгидразина. Под влиянием больших доз количество эритроцитов снижается через 2—3 дня на 40—50%, повышается цветной показатель, появляются в периферической крови полихроматофильные, вакуолизированные и содержащие патологические структуры эритроциты; значительно увеличивается максимальная осмотическая резистентность эритроцитов, повышается число ретикулоцитов; развивается умеренный лейкоцитоз без нарушения лейкоцитарной формулы; увеличивается вязкость и свертываемость крови.
При длительном введении фенилгидразина появляются мегалоциты и мегалобласты, наблюдается отложение гемосидерина в костном мозге, селезенке и печени. С 8—10-го дня развиваются очаги экстрамедуллярного гемопоэза, увеличиваются в размере селезенка и печень. В лейкоцитарной формуле — сдвиг влево до миелоцитов. Большие дозы фенил гидразина могут вызвать апластическую анемию.
Гиперхромная мегало-бластическая анемия у животных вызывается внутривенным введением водного раствора сапонина в количестве 1—5 мг/кг в течение 5 дней в возрастающей (по 1 мг в день) дозе. Число эритроцитов уменьшается на 50%, гемоглобина — на 25—30%. Показатели периферической крови восстанавливаются через 20—25 дней. При комбинации сапонина с колларголом (0,3—0,5 мг/кг) анемии поддерживается до 40 дней. Аллоксан (180 мг/кг в виде 10% раствора) вызывает анемию у животных через 2— 3 дня. Как гемолитический яд применяют свинец, толуилендиамин, пирогаллол, мышьяковистый водород, но они вызывают и другие проявления интоксикации.
Нейрогенная анемия может быть вызвана нарушением целостности различных структурных образований нервной системы, например денервацией синокаротидной рефлексогенной зоны, селезенки, почек, тонкой кишки и другого. А. можно вызвать также повторным введением животным под кожу ацетилхолина, карбохолина и других холинергических веществ. Развивается умеренная гипохромная анемии. Количество гемоглобина и эритроцитов максимально снижается на 9—15-й день после операции. В крови при этом обнаруживают вещества, угнетающие эритропоэз. Восстановление показателей периферической крови происходит в течение 20—40 дней.
Органопривные анемии развиваются у животных после удаления части или всего желудка, части тонкой кишки или печени, при хронической потере желчи (через фистулу желчного пузыря), после гипофизэктомии. При сочетании гастрэктомии с нарушением питания у собак развивается гипопластическая анемия.
Алиментарная анемия. Длительное снижение калорийности пищи, особенно обеднение ее белками, а также недостаток железа, меди, кобальта вызывает у животных анемию различного характера;дефицит фолиевой кислоты и витамина В12 вызывает гиперхромную мегалобластическую анемию.
|
Алексеев Г.А., Катехелидзе М.Г., Неменова H.M., Тур А.Ф., Федоров Н.А., Хакимова С.X., Цфасман А.3. |

|
⇐ Перейти на главную страницу сайта |
⇑ Вернуться в начало страницы ⇑ |
Библиотека Ordo Deus ⇒ |
⇐ Аневризма сосудов головного мозга |
⇓ Каталог систематический ⇓ |
Анетодермия ⇒ |
|
Все статьи в полном изложении, Вы можете найти в большой медицинской энциклопедии — Главный редактор: академик АН СССР (РАН) и АМН СССР (РАМН) Б.В. Петровский. — Москва издательство «Советская энциклопедия» 1989г. |
|
Внимание! Вы находитесь в библиотеке «Ordo Deus». Все книги в электронном варианте, содержащиеся в библиотеке «Ordo Deus», принадлежат их законным владельцам (авторам, переводчикам, издательствам). Все книги и статьи взяты из открытых источников и размещаются здесь только для чтения. |
|
Библиотека «Ordo Deus» не преследует никакой коммерческой выгоды. |
|
Все авторские права сохраняются за правообладателями. Если Вы являетесь автором данного документа и хотите дополнить его или изменить, уточнить реквизиты автора, опубликовать другие документы или возможно вы не желаете, чтобы какой-то из ваших материалов находился в библиотеке, пожалуйста, свяжитесь с нами по e-mail: |
Вас категорически не устраивает перспектива безвозвратно исчезнуть из этого мира? Вы желаете прожить ещё одну жизнь, начав всё заново? Вы желаете прожить ещё одну жизнь без ошибок совершённых в этой жизни? Вы желаете прожить ещё одну жизнь, осуществив в ней мечты несбывшиеся в этой жизни? Перейдите по ссылке: «главная страница».
|
© Ordo Deus, 2010. При копировании ссылка на сайт http://www.ordodeus.ru обязательна. |